常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
| A.同物质的量浓度的三种溶液的pH:a>b>c |
| B.同pH时,三种溶液稀释相同倍数后,pH:a<b<c |
| C.同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c |
| D.同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3主要:Cu2+ + CO32─ + H2O = Cu(OH)2↓+ CO2↑ 次要:Cu2+ + CO32─= CuCO3↓
(2) CuSO4 +Na2S 主要:Cu2+ + S2─ = CuS↓ 次要:Cu2+ + S2─+ 2H2O = Cu(OH)2↓+ H2S↑
则下列几种物质的溶解度大小的比较中,正确的是
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2< CuS < CuCO3 |
在25℃时,AgX、AgY、AgZ均难溶于水,且Ksp(AgX) = 1.8×10-10,Ksp(AgY) = 1.0×10-12,Ksp(AgZ) = 8.7×10-17。下列说法(均在25℃)错误的是
| A.三种饱和溶液中溶质的物质的量浓度的大小顺序为c(AgX)>c(AgY)>c(AgZ) |
| B.若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)减少 |
| C.若取0.188g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为1.0×10-2mol·L-1 |
| D.往C选项的溶液中加入1 mL 0.1mol·L-1的NaZ溶液,能生成AgZ沉淀 |
硼酸在玻璃制造和医药领域应用广泛。硼酸(H3BO3)溶液中存在如下电离过程:
H3BO3(aq)+H2O(l) 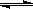 [B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)。下列有关硼酸的说法不正确的是( )
[B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)。下列有关硼酸的说法不正确的是( )
| A.25℃时0.7mol·L–1硼酸溶液中H+的浓度为2.0×10–5mol·L—1。 |
| B.硼酸与NaOH反应的离子方程式为H3BO3+OH–= [B(OH)4]–。 |
| C.碳酸钠溶液滴入硼酸中能观察到有气泡产生(已知碳酸的电离常数:K1=4.4×10—7、K2=4.7×10—11) |
| D.等物质的量浓度的Na[B(OH)4]溶液和CH3COONa溶液的pH:前者>后者(已知酸酸的电离常数K=1.75×10—5) |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
20℃时H2S饱和溶液1 L,其浓度为0.1 mol / L,若要使溶液的pH和c(S2-)减小,可采取的措施是 ( )
| A.加入适量的CuSO4固体 | B.加入少量的氢氧化钠固体 |
| C.通入适量的H2S气体 | D.加入适量水 |
在0.lmol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+ 对于该平衡,下列叙述正确的是
CH3COO-+H+ 对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向正向移动, 溶液中c(H+)增大 |
| B.加水,平衡向正向移动, c(CH3COOH)/ c(CH3COO-)增大 |
| C.通入少量 HCl,平衡逆向移动,溶液中c(H+)减少 |
| D.加入少量CH3COONa固体,平衡向逆向移动,溶液导电能力增强 |
已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液
中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是 ( )
| A.25℃时,0.1 mol·L-1 HF溶液中pH=1 | B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中没有沉淀产生 | D.该体系中HF与CaCl2反应产生沉淀 |
已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,下列叙述正确的是( )
| A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| C.向0.0008 mol·L- 1的K2CrO4溶液中加入等体积的0.002mol/LAgNO3 溶液,则CrO42-完全沉淀 |
| D.将0.001 mol·L- 1的AgNO3 溶液滴入0.001 mol·L- 1的KCl和0.001 mol·L- 1的K2CrO4溶液,则先产生AgCl沉淀 |
下图表示的是难溶氢氧化物在不同pH下的溶解度(S/mol·L-1),下列说法中正确的是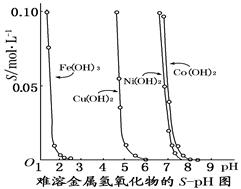
| A.pH=3时溶液中铁元素的主要存在形式是Fe3+ |
| B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去 |
| C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右 |
| D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀 |
水中加入下列溶液对水的电离平衡不产生影响的是
| A.NaHSO4溶液 | B.NaOH溶液 | C.KAl(SO4)2溶液 | D.KI溶液 |
水的电离过程为H2O H+ + OH-,在不同温度下其离子积为:Kw(25℃)=1×10-14, Kw(35℃)=2.1 ×10-14。则下列叙述正确的是
H+ + OH-,在不同温度下其离子积为:Kw(25℃)=1×10-14, Kw(35℃)=2.1 ×10-14。则下列叙述正确的是
| A.c(H+)随着温度的升高而降低 | B.在35℃时,纯水中 c(H+) >c(OH-) |
| C.水的电离常数K(25℃)>K(35℃) | D.水的电离是一个吸热过程 |
下列变化不能用勒夏特列原理解释的是
| A.红棕色的NO2气体加压后颜色先变深再变浅 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 |
| D.打开汽水瓶,看到有大量的气泡逸出 |