下列有关活化分子和活化能的说法不正确的是
| A.增加气体反应物的浓度可以提高活化分子百分数 |
| B.升高温度可增加单位体积活化分子数 |
| C.发生有效碰撞的分子一定是活化分子 |
| D.使用催化剂可降低活化能,提高单位体积活化分子百分数 |
某温度下,在容积固定不变的密闭容器中进行如下可逆反应:X(g)+Y(g)=Z(g)+W(s) ΔH > 0,一段时间后,达到化学平衡状态。下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.通入一定量氦气,压强增大,平衡向正反应方向移动 |
| C.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| D.降低温度,正反应速率减小,逆反应速率也减小,平衡向逆反应方向移动 |
NO和CO都是汽车排放尾气中的有害物质,它们能缓慢地反应,生成N2和CO2,对此反应下列叙述正确的
| A.使用催化剂并不能改变反应速率 | B.使用催化剂可以加快反应速率 |
| C.降低压强能加快反应速率 | D.降温可以加快反应速率 |
下列有关说法正确的是
| A.实验室制氢气,为了加快反应速率,可向稀 H2SO4中滴加少量 Cu(NO3)2溶液 |
B.N2(g)+3H2(g)  2NH3(g) ΔH<0,其他条件不变升高温度,平衡时氢气转化率增大 2NH3(g) ΔH<0,其他条件不变升高温度,平衡时氢气转化率增大 |
C.吸热反应“TiO2(s)+2Cl2(g)  TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的ΔS<0 TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的ΔS<0 |
| D.为处理锅炉水垢中的 CaSO4,可先用饱和 Na2CO3溶液浸泡,再加盐酸溶解 |
下列说法正确的是
| A.活化分子间所发生的碰撞为有效碰撞 |
| B.增大反应物浓度,可增大活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子百分数 |
| D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大 |
将等质量的A、B两份过量的锌粉装入试管中,分别加入浓度和体积均相同的稀硫酸,同时向装A的试管中加入少量CuSO4溶液。如图表示产生氢气的体积V与时间t的关系,其中正确
在气体反应中,能使反应物活化分子数和活化分子百分数同时增加的方法是①增加反应物的浓度 ②升高温度 ③移去生成物 ④增大压强 ⑤加入催化剂
| A.①③ | B.①⑤ | C.②⑤ | D.②④ |
某研究小组利用“钯催化交叉偶联反应”合成了有机物丙,合成路线如下:
下列分析判断正确的是
| A.分离提纯有机物丙宜在NaOH热溶液中进行 |
| B.PbCl2的作用是提高反应物的活性,加快反应速率 |
| C.可用酸性KMnO4溶液检验有机物丙中是否含有机物乙 |
| D.利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量可向盐酸中加入适量的
| A.NaOH固体 | B.同浓度的醋酸溶液 | C.NH4Cl固体 | D.CH3COONa固体 |
根据下列有关实验得出的结论一定正确的是
| 选项 |
方法 |
结论 |
| A |
实验室制氢气,向稀H2SO4中滴加少量Cu(NO3)2溶液 |
可以加快制备氢气的反应速率 |
| B |
向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液, 则溶液变黄 |
氧化性:H2O2>Fe3+ |
| C |
相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 |
反应速率: 粉状大理石>块状大理石 |
| D |
吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行 |
则该反应的△S<0 |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+ 3B2(g)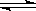 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
A.若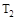 > >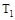 ,则正反应是放热反应 ,则正反应是放热反应 |
B.达到平衡时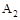 的转化率大小为:b>a>c 的转化率大小为:b>a>c |
C.若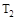 > >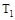 ,达到平衡时b、d点的反应速率为 ,达到平衡时b、d点的反应速率为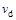 > >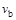 |
D.在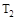 和 和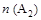 不变时达到平衡, 不变时达到平衡,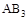 的物质的量大小为:c>b>a 的物质的量大小为:c>b>a |
高温下,某反应达到平衡,平衡常数K= ,恒容时,温度升高,H2浓度减小。下列说法正确的是
,恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为CO+H2O  CO2+H2 CO2+H2 |