某化学反应 3 A  2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验 1 ,反应在10 min ~20 min 内平均速率为_______ mol /(L·min)
(2)在实验 2 ,A 的初始浓度 C2 _______ mol / L ,反应经 20 min 就达到平衡,可推测实验 2 中还隐含的条件是____________________________
(3)比较实验3和实验 1,可推测正反应是______反应(填吸热或放热)。理由是____
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l) CH3COOC2H5(l)+H2O(l) ΔH=-8.62kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
(1)该研究小组的实验目的是__________________。
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是______(写出两条)。
(4)某温度下,将0.10 mol CH3COOH溶于水配成1 L溶液。
①实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,则该温度下CH3COOH的电离平衡常数K=____________________。(水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计)
②向该溶液中再加入__________mol CH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
(每空2分,共16分)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH===CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH:
CH3CH2CH2CH2OH:
CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。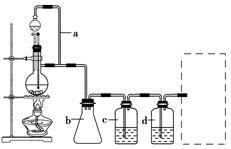
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯。写出化学方程式: ____________________________________________________________________________。
(2)若用以上装置制备H2,在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓ ;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线: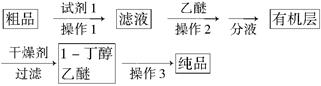
试剂1为________,操作1为________,操作2为________,操作3为________。
下表是稀硫酸与金属镁反应的实验数据:
| 实验 序号 |
金属质量/g |
金属 状态 |
c(H2SO4) /mol/L |
V(H2SO4)/mL |
溶液温度/℃ |
金属消失 的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.24 |
丝 |
0.5 |
100 |
20 |
34 |
500 |
| 2 |
0.24 |
粉末 |
0.5 |
100 |
20 |
35 |
50 |
| 3 |
0.24 |
丝 |
0.7 |
100 |
20 |
36 |
250 |
| 4 |
0.24 |
丝 |
0.8 |
100 |
20 |
35 |
200 |
| 5 |
0.24 |
粉末 |
0.8 |
100 |
20 |
36 |
25 |
| 6 |
0.24 |
丝 |
1.0 |
100 |
20 |
35 |
125 |
| 7 |
0.24 |
丝 |
1.0 |
100 |
35 |
50 |
50 |
| 8 |
0.24 |
丝 |
1.1 |
100 |
20 |
34 |
100 |
| 9 |
0.24 |
丝 |
1.1 |
100 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)其中仅表明反应物浓度对反应速率产生影响是实验2和实验 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ____ ,能表明这一规律的分别是实验6和实验 或实验8和实验 ;(填实验序号);
(4)实验中的所有反应,反应速率最快是实验 (填实验序号),该实验中硫酸平均反应速率为 ;
阅读下列文字,填写文中带圈的数字后面的空白:
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。
(一)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:① ;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:②
(二)该同学取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
1.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
2.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验1中③ ,实验2中④ ,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
| 实验序号 |
金属质量/g |
金属状态 |
c(H2SO4) mol/L |
实验温度/℃ |
金属消失的时间/s |
|
| 1 |
0.10 |
丝 |
0.7 |
20 |
250 |
|
| 2 |
0.10 |
丝 |
1.0 |
20 |
200 |
|
| 3 |
0.10 |
粉末 |
1.0 |
20 |
125 |
|
| 4 |
0.10 |
粉末 |
1.0 |
30 |
50 |
分析上述数据,回答下列问题:
(1)反应的离子方程式: 。
(2)①实验1、2可得出的结论是 ;
②实验2、3可得出的结论是 ;
③实验3、4可得出的结论是 。
两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间。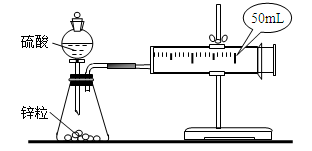
(1)当收集到10mL H2时,哪个实验所耗时间较长?为什么?
_________________________________________________________________________________
(2)活塞外移的情况是_______________。
| A.均匀外移 | B.先快后慢 | C.先慢后快 | D.先慢后快然后又逐渐减慢 |
你选择的理由是___________________________________________________________。
为了研究碳酸钙与盐酸反应的反应速率,某同学通过下图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线,在该实验过程中发现锥形瓶温度升高。请分析讨论以下问题。
(1)在O ~ t1、t1 ~ t2、t2 ~ t3各相同的时间段里,反应速率最大的时间段是 ,可能的原因是 ;收集到的气体最多的是 时间段。
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有 ;
| A.蒸馏水 | B.NaCl固体 | C.NaCl溶液 | D.通入HCl |
(3)在t4后,收集到的气体的体积不再增加,可能的原因是 。
某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
| 实验 编号 |
温度/K |
盐酸浓度 /mol·L-1 |
醋酸浓度/mol·L-1 |
实验目的 |
| ① |
298 |
0.20 |
|
a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 |
| ② |
308 |
0.20 |
|
|
| ③ |
298 |
0.40 |
|
|
| ④ |
|
0.20 |
0.20 |
|
| ⑤ |
|
|
|
(1)请完成上工作表(填写实验④⑤的空格)。
(2)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系如图:
Ⅰ假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是 。
Ⅱ若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
下面是某研究小组研究的关于不同催化剂对H2O2分解反应的催化效率。
| 催化剂(0.1g) |
活性炭 |
FeCl3 |
KI |
MnO2颗粒状 |
MnO2粉末状 |
| 前15s产生氧气的量(ml) |
5 |
11 |
7 |
8 |
11 |
| 前30s产生氧气的量(ml) |
8 |
16 |
11 |
11 |
21 |
| 前45s产生氧气的量(ml) |
11 |
20 |
15 |
18 |
35 |
| 前60s产生氧气的量(ml) |
15 |
24 |
20 |
26 |
49 |
(1)写出H2O2在催化剂作用下分解反应的化学方程式______________________________
(2)从上表可以得出:
活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是__________
等质量的固体催化剂,颗粒大小对催化效率有什么影响__________________________
(3)实验发现新鲜的动物肝脏对H2O2的分解也有显著的催化作用,但当往溶液中加入盐酸,或给溶液加热时,就会失去催化能力,合理的解释是
(4)对于FeCl3的催化作用,有人认为是Fe3+起催化作用,有人认为是Cl-,请你设计一个实验进行验证。
___________________________________________________________
某学生小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.00 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 编号 |
T/K |
大理石规格 |
HNO3浓度 / mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(I)实验①和②探究HNO3浓度对该反应速率的影响; |
| ② |
298 |
粗颗粒 |
|
(II)实验①和③探究_________对该反应速率的影响; (Ⅲ)实验①和________探究大理石规格(粗、细)对该反应速率的影响。 |
| ③ |
308 |
粗颗粒 |
2.00 |
|
| ④ |
298 |
|
2.00 |
(2)实验①中CO2的物质的量随时间变化的关系见图:
计算在70—90 s范围内HNO3的平均反应速率(忽略溶液体积变化)。
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有;
(2)硫酸铜溶液可以加快氢气生成速率的原因是;
(3)实验室中现有、
、
、
等4种溶液,可与实验中
溶液起相似作用的是;
(4)要加快上述实验中气体产生的速率,还可采取的措施有(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
||||||
| 4 |
30 |
|||||
| 饱和 |
0 |
0.5 |
2.5 |
5 |
20 |
|
| 10 |
0 |
①请完成此实验设计,其中:1=,
6=,
9=;
②反应一段时间后,实验中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量溶液时,生成氢气的速率会大大提高。但当加入的
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
“碘钟”实验中,3I- + S2O82- = I3- + 2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O82-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= .
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
某学习小组在通过反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3名称为硫代硫酸钠,俗称海波,可以看成是用一个S原子取代了Na2SO4中的一个O原子而形成。该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究验证自己的预测。
[提出假设]
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH 7(填“>”、“=”或“<”)
(2)部分学生从S元素化合价推测Na2S2O3与SO2性质相似,均具有较强的 。
[实验探究]
取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写下表中空格)。
[实验结论]
(6)探究①: 。
(7)探究②: 。
[问题讨论]
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由
。
(9)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化。你的方案是
。
(10分,每空2分)甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离平衡常数为5.4×10-2)

 。
。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
| 序号 |
A溶液 |
B溶液 |
| ① |
2 mL 0.1 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
| ② |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
| ③ |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
该实验探究的是 对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是 (用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。
取两支试管各加入2 mL 0.1  mol/L
mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合
H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合 并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。