(一)下列有关实验操作或判断不正确的是 (填序号,多选扣分)。
A、配制一定物质的量浓度溶液,定容时平视刻度线。
B、苯、四氯化碳、乙醇三种有机溶剂都可用来萃取溴水中的溴。
C、让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路”。
D、配制100mL 1mol/L 的NaOH溶液,需称量4g 的氢氧化钠固体。
E、用铂丝蘸取少量溶液做焰色反应,没有观察到紫色,所以该溶液中不含钾元素
(二)实验室需要480mL0.1mol/LNa2CO3溶液,现用碳酸钠晶体配制,回答下列问题
(1)应用托盘天平称取十水合碳酸钠(Na2CO3·10H2O)晶体 g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,1g以下用游码,天平平衡时,则实际称量的十水合碳酸钠质量 (填偏高、偏低、不变)。
(3) Na2CO3、 、 。
(4) 若实验遇下列情况,溶液的浓度将会(填偏高、偏低、不变)
A、加水定容时俯视刻度线
B、容量瓶内壁附有水珠而未干燥处理
C、颠倒摇匀后发现凹液面低于刻度线又加水补上
D、称量的碳酸钠晶体部分失结晶水
(5)若定容是加水超过了刻度线,正确的处理方法是
(6)请你帮助把标签上的内容写一下(如右图)。
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。


I II
(1)写出下列仪器的名称:
a. b. c.
(2)仪器a~e中,使用前必须检查是否漏水的有 。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水由 (填f或g)口通入 口流出。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,反复颠倒摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(5)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为______________________;
(6)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作 ;若加蒸馏水时不慎超过了刻度线 ;若定容时俯视刻度线___________________。
(7)若实验过程中加蒸馏水时不慎超过了刻度线应如何处理? 。
某学生欲配制6.0 mol/L的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:①480 mL 0.5 mol/L的硫酸;②150 mL 25%的硫酸(ρ=1.18 g/mL);③足量的18 mol/L的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为____________mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为____________mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol/L的浓硫酸____________mL,沿玻璃棒倒入上述混合液中,并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.____________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1 cm~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?____________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意______________________。
用9mol/L的浓硫酸稀释成 0.9mol/L的稀硫酸 100mL ,回答下列问题:
(1)配制操作可分解成如下几步,以下正确的操作顺序是_____________________
A向容量瓶中注入少量蒸馏水,检查是否漏水
B用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm
(2)如果实验室用98%的浓硫酸(密度为1.8g·cm-3 ) 配制3.6 mol·L-1的稀硫酸250mL。计算用量简量取所需浓硫酸的体积为_____________mL。
(3)由于错误操作, 使得到的浓度数据比正确的偏大的是___________(填写序号)。
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而未干的试剂瓶中备用
右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该盐酸中HCl的物质的量浓度为 mol·L–1
(2)某同学用上述浓盐酸和蒸馏水配制浓度为0.4mol·L–1体积为425 mL的稀盐酸。
①该学生需要取 mL上述浓盐酸进行配制。
②配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需 、
。
③上述实验中,需要用到玻璃棒,其作用是 、 。
④在配制过程中,下列操作对配制的稀盐酸的物质的量浓度有何影响(填“偏大”、“偏小”或“无影响” )
I.用量筒量取浓盐酸时俯视观察凹液面
II.定容时仰视刻度线
实验室配制500mL0.1mol/LNa2CO3溶液。回答下列问题
(1) 用托盘天平应称取十水碳酸钠(Na2CO3·10H2O)晶体的质量为 。
(2) 用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的编号为(同一步骤可用多次): B→( )→( )→( )→B→( )→( )→( )。
A、调整零点
B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量
D、称量空的小烧杯
E、将砝码放回砝码盒内
F、记录称量结果.
(3) 本实验需用的主要仪器有
(4) 若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A、定容时俯视刻度线
B、没有将洗涤液转入容量瓶
C、容量瓶内壁附有水珠而未干燥处理
甲乙两位同学分别用不同的方法配制100mL 3.6mol/L的稀硫酸。
(1)若采用18mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为 。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是__ 。
③定容的正确操作是
④下列操作会使配得的溶液浓度偏小的是( )
| A.容量瓶中原有少量蒸馏水 |
| B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C.定容时观察液面俯视 |
| D.胶头滴管加水时,有少量水滴到容量瓶外 |
(3)乙学生:用100 mL 量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL 刻度线,再搅拌均匀。
你认为此法是否正确?若不正确,指出其中错误之处
把18.0mol·L-1的浓硫酸稀释成2.00mol·L-1的稀硫酸100ml,实验操作如下:
| A.将配好的稀硫酸倒入试剂瓶中,贴好标签; |
| B.盖好容量瓶塞,反复颠倒,摇匀; |
| C.用量筒量取ml的18.0mol·L-1的浓硫酸; |
| D.将沿烧杯内壁慢慢注入盛有少量的烧杯中; |
E.用少量蒸馏水洗涤烧杯和玻璃棒2-3次,并将洗涤液也全部转移到容量瓶中;
F.将已冷却至室温的硫酸溶液沿玻璃棒注入 mL的容量瓶中;
G.改用胶头滴管逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H.继续向容量瓶中加蒸馏水,直到液面接近刻度线1-2cm处。
(1)填写上述步骤中的空白:C ;D将 注入 ;F ;
(2)请按正确的操作步骤进行排序 。
(3)试分析下列操作会使所配溶液的浓度偏高的是
①洗涤了量取浓硫酸的量筒,并把洗涤液转移到容量瓶中;②转移溶液前,容量瓶中含有少量蒸馏水;③溶解硫酸用的烧杯、玻璃棒未洗涤;④定容时俯视容量瓶的刻度线;⑤定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线;⑥量取浓硫酸时俯视读数
(18分,每小题2分)用质量分数为98%,密度为1.84g/cm3的浓硫酸来配置500ml,0.2mol/L的稀硫酸。可供选择①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有 (填代号) .
(2)经计算,需浓硫酸的体积为 mL(保留一位小数); 。
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用 玻璃棒 .转移完毕,用少量蒸馏水洗涤 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近瓶颈刻度 cm处,改用 滴加蒸馏水,使 .塞上瓶塞、摇匀后,把溶液倒入试剂瓶、贴上标签.
(4)定容时,俯视刻度线,所配溶液的物质的量浓度将 (选填“偏高”、“偏低”或“不变”)
(8分)用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A 100 mL量筒 B玻璃棒 C 50 mL容量瓶 D 10 mL量筒
E 胶头滴管 F 50 mL烧杯 G 100 mL容量瓶
(1)需量取浓硫酸的体积为 mL,
(2)实验时不选用的仪器有(填序号) ,
(3)配制过程中,下列情况会使配制结果偏高的是(填序号) ,
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④浓硫酸在烧杯中稀释后未冷却到室温就转移到容量瓶中定容
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用蒸馏水洗净后,再用待配液润洗 |
| C.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀 |
| D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线 |
(12分)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制500 mL、0.2 mol·L-1的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④托盘天平 ⑤量筒 ⑥药匙
请完成下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有________(填代号),
除上述仪器外,还缺少的必要仪器是
(2)经计算,需浓硫酸的体积为________,现有①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,你选用的量筒是________(填代号)。
(3)在配制过程中,其他操作都准确,下列操作中错误的是_____ ___________,能引起误差偏高的有_____ ___(填代号)。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中 ③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸 ④定容时,加蒸馏水超过标线,又用胶头滴管吸出 ⑤转移前,容量瓶中含有少量蒸馏水 ⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线 ⑦定容时,俯视标线
(9分)实验室用氯化钠固体配制100mL 1.0 mol·L-1的NaCl溶液,有如下操作步骤:
①用托盘天平称量____________g NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②继续向容量瓶中加蒸馏水至液面距刻度线1-2cm处,改用_____________小心滴加蒸馏水至溶液凹液面的最低处与刻度线相切;
③把①中所得溶液小心地转入______________________中;
④将容量瓶塞紧,充分摇匀;
⑤用少量蒸馏水洗涤烧杯与玻璃棒2-3次,洗涤液一并转移到容量瓶中。
(1)将上述步骤的空白处填空;
(2)本实验操作步骤的正确顺序是(填序号,不能重复) ;
(3)试分析下列操作对所配得溶液的浓度有何影响(填:“偏高”、“偏低”、
或“无影响”)
①容量瓶用蒸馏水洗净后没有干燥就直接用来配溶液,所配得溶液的浓度 ;
②定容时,仰视刻度线,所配得溶液的浓度 ;
③定容后,加盖倒转摇匀后,发现液面低于刻度线,所配得溶液的浓度 。
水泥是重要的建筑材料。水泥熟料的主要成分为 、 ,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
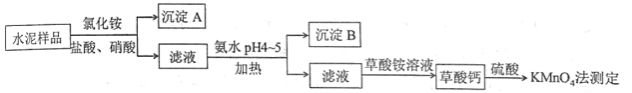
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀 处理后,用 标准溶液滴定,通过测定草酸的量可间接获知钙的含 量,滴定反应为: 。实验中称取 水泥样品,滴定时消耗了 的 溶液 ,则该水泥样品中钙的质量分数为______________。
现有下列化学仪器与用品:①玻璃棒 ②烧杯 ③托盘天平 ④量筒 ⑤药匙 ⑥胶头滴管 ⑦容量瓶 ⑧标签纸 ⑨细口试剂瓶
Ⅰ.称量:若需要配制500 mL 0.622 moL / L NaOH溶液,则应称取固体NaOH g;
Ⅱ.用以上称量后的NaOH固体配制溶液并备用:按配制溶液的过程顺序,从上述所给仪器和用品中选取需要的仪器(重复的不计),其编号排列是 ;
Ⅲ.配制过程中,应将固体NaOH溶解后并冷却至室温的溶液转移到 中,在转移时玻璃棒起 作用;在液面接近容量瓶刻度线 处,改用 定容。
Ⅳ.若实验中遇到下列情况,可能导致溶液浓度偏高的是 (填字母):
| A.固体氢氧化钠溶解时未冷却至室温,就开始转移、洗涤以及定容; |
| B.转移时不小心有少量溶液流到了容量瓶外; |
| C.定容时仰视容量瓶刻度线; |
| D.定容时加水超过了刻度线,马上用胶头滴管吸去多余的水。 |
E、配制好后,发现称量时所用的托盘天平的砝码生锈了
下图为两套实验装置。
(1)写出下列仪器的名称:


① ;② 。
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填序号)
(3)若利用装置I制取蒸馏水,还缺少的仪器是 ,将仪器补充完整后进行的实验操作的名称为: ,冷却水从 口进。
(4)某学生欲用11.9 mol/L浓盐酸和蒸馏水配制480mL物质的量浓度为0.400 mol/L的稀盐酸.
①其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是 、 。
②将下列操作填写完整,并排列其正确的操作顺序(字母表示,每个字母只用一次)_ _ _ _;
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒准确量取浓盐酸_________ mL,注入烧杯中,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃杯注入_________ 中 |
| D.将容量瓶盖紧,颠倒摇匀 |
E.改用_________ 加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度线_________ 处.
③若配制时,因加水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?________
④在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是__________。
a没有洗涤烧杯和玻璃棒
b转移溶液时不慎有少量溶液洒到容量瓶外面
c容量瓶不干燥,含有少量蒸馏水
d定容时俯视刻度线
e定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线