右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
现用该浓硫酸配制980 mL 0.1 mol/L的稀硫酸。可供选用的仪器有:

①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平⑦玻璃棒
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有 (写仪器名称);
(2)配制0.1mol/L的稀硫酸980mL需用量筒量取上述浓硫酸体积为 mL。
(3)实验中两次用到玻璃棒,其作用分别是: 、 。
(4)配制时,一般可分为以下几个步骤:①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为 。(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏高有 (填序号)。
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
⑤定容时,俯视刻度线
某化学小组欲以CO2主要为原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究。请你参与并完成对有关问题的解答。
【资料获悉】
1、“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3。
2、Na2CO3与盐酸反应是分步进行:Na2CO3先与盐酸反应生成NaHCO3;然后再发生NaHCO3+HCl=NaCl+H2O +CO2↑
【实验设计】
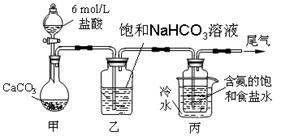
【实验探究】
(1)装置乙的作用是 。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 。
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如下图所示。
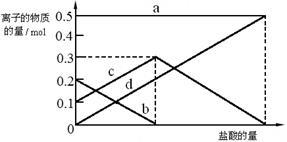
则曲线c对应的溶液中的离子是 (填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是 。
(4)若将装置甲产生的纯净的CO22.24L(标准状况下)通入100mLNaOH溶液中,充分反应后,将溶液小心蒸干,得到不含结晶水的固体W,其质量为10.16g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取盐酸体积/mL |
应选用容量瓶的规格/mL |
除容量瓶外还需的其它仪器 |
| |
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为 ;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响” )
若没有进行A操作 ;若加蒸馏水时不慎超过了刻度 ;若定容时俯视刻度线 。
(5)若实验过程中出现如下情况如何处理:加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤(2))不慎有液滴掉在容量瓶外 。
用 18 mol/L 的浓硫酸配制 100 mL 3.0 mol/L 稀硫酸的实验步骤如下: ① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 稀释 ④ 检漏、 转移、洗涤 ⑤ 定容、摇匀 回答下列问题:
(1)所需浓硫酸的体积是________mL , 量取浓硫酸所用的量筒的规格是_________(用下列编号填空) 。
| A.10 mL | B.25 mL | C.50 mL | D.100 mL |
(2)第③步实验的具体操作是_____________________________________
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线__________, 改用___________向容量瓶中滴加蒸馏水至___________为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)下列情况对所配制的稀硫酸浓度有何影响? (填 “ 偏大 ”“ 偏小 ” 或 “ 无影响”)
①所用的浓硫酸长时间放置在密封不好的容器中 ______________;
②容量瓶用蒸馏水洗涤后残留有少量的水_________________;
③在转入容量瓶前烧杯中溶液未冷却至室温_________;
④加水超过刻度线后, 用胶头滴管吸出多余的液体___________。
某同学需要用到120 mL 1 mol/L的盐酸溶液,现用密度为1.18 g/mL,质量分数为36.5%浓盐酸配制,填空并请回答下列问题:
(1)配制1 mol/L的盐酸溶液
| 量筒量取浓盐酸体积/mL |
应选用量筒的规格(可供选择的规格10 mL、25 mL、50 mL) |
应选用容量瓶的规格(可供选择的规格100 mL、250 mL、500 mL) |
除容量瓶外还需要的其它仪器 |
| ① |
② |
③ |
④ |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) __ _____;
A、用30 mL水洗涤烧杯内壁和玻璃棒2—3次,洗涤液均注入容量瓶,振荡
B、用量筒准确量取所需的浓盐酸的体积,将量好的浓盐酸倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正 。
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①所用的浓盐酸长时间放置在密封不好的容器中 ;
②若加蒸馏水时不慎超过了刻度 ;
③若定容时俯视刻度线___________________;
④用量筒量取浓盐酸时仰视 ;
实验室用浓盐酸配制250mL0.1mol/L的盐酸溶液:
Ⅰ.(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为 。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是 。
A、溶解后的溶液未冷至室温就转入容量瓶中;
B、洗涤烧杯和玻棒的溶液未转入容量瓶中;
C、定容时眼睛俯视刻度线;
D、定容时眼睛仰视刻度线;
Ⅱ.(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图: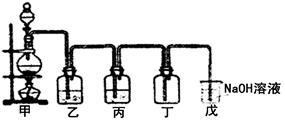
 ①写出甲中发生反应的离子方程式:________
①写出甲中发生反应的离子方程式:________
②乙中盛的试剂是 ;作用是 。丙中盛的试剂是 。
(2)如果将过量二氧化锰与20 mL该浓盐酸混合加热,充分反应后理论上可生成标况下的氯气的体积为 mL,而实际值明显少于理论值,其主要原因有:
① ;
② 。
(3)若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变 色,其离子方程式是 ,向所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层是显 色,这种操作叫做 。
(4)若将制得的氯气制成饱和氯水,则实验室保存饱和氯水的方法是 。
(5)用滴管将新制饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去,褪色的原因可能有两种(用简要文字说明)①是由于 ;②是由于 。简述怎样用实验证明红色褪去的原因是①或者② 。
生活中为了延长鲜花的寿命,通常会在花瓶中加入“鲜花保鲜剂”。下表是0.5L某种“鲜花保鲜剂”中含有的成分及含量,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g/mol) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.25 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.25 |
158 |
| 硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是 。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol·L-1。
(要求用原始数据书写出表达式,不需要化简)
(3)为了研究不同浓度的“鲜花保鲜剂”的保鲜功效,需配制多份不同物质的量浓度的溶液进行研究。现欲配制480mL某物质的量浓度的“鲜花保鲜剂”,所需的玻璃仪器有:烧杯、玻璃棒、 、 。(在横线上填写所缺仪器的名称)
(4)配制上述 “鲜花保鲜剂”时,其正确的操作顺序是(用字母表示,每个操作只用一次) 。
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G.用电子天平称量各组成成分,并把它们放入烧杯中混合
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是 。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“鲜花保鲜剂”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线。
实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
(2)在容量瓶的使用方法中,下列操作不正确的是____________
| A.容量瓶洗涤后残留少量水不影响使用 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制NaOH溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.配制硫酸溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次摇匀。
(3)用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL(保留到小数点后1位。),若实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好。
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数数值,其实验方案的要点为:①用直流电源电解CuCl2溶液,所用仪器如下图所示。②在电流强度为IA,通电时间为t min后,精确测得电极上析出铜的质量为m g。
试回答:(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示):
E接 ,C接 , 接F。
(2)写出B电极上发生的电极反应式: ;
G试管中淀粉KI溶液变化的现象为 ,
相应的离子方程式是 。
(3)为精确测定电极上析出的铜的质量,所必需的实验步骤的先后顺序应是 (选填下列操作步骤的编号)。
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后的电极 ④低温烘干电极后称量
⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算式:NA= 。
实验室需要配制0.1 mol/L NaOH溶液450 mL,回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)
(2)下列操作中,容量瓶所具备的功能有 (填序号)。
A.贮存溶液
B.配制一定体积准确浓度的标准溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为 g;
(4)取用任意体积的所配0.1 mol/L NaOH溶液时,下列物理量中不随所取体积的多少而变化的是(填字母) ;
A.溶液中NaOH的物质的量 B.溶液的浓度
C.溶液中Na+的数目 D.溶液的密度
(5)将所配制的NaOH溶液进行测定,发现浓度大于0.1 mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
某探究性学习小组拟用小颗粒状铝硅合金与足量稀硫酸的反应,测定通常状况(约20℃,1 atm)下气体摩尔体积的方法。拟选用下列实验装置完成试验:
(1)该组同学必须选用的装置的连接顺序是(用管口字母,可不填满):
A接( )( )接( )( )接( )
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,开始稀硫酸能滴入锥形瓶中,一会儿后稀硫酸不能顺利滴入锥形瓶。请你帮助分析原因__________________。
(3)实验结束时,该组同学应怎样测量实验中生成氢气的体积?_______________。
(4)实验中准确测得4个数据:实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,实验后量筒中液面读数为VmL。则通常状况下气体摩尔体积Vm=_________。若合金中含铜,测得的Vm将________(偏大/偏小/无影响)。
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数数值,其实验方案的要点为:①用直流电源电解CuCl2溶液,所用仪器如下图所示。②在电流强度为I A,通电时间为t min后,精确测得电极上析出铜的质量为m g。
试回答:(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示):
E接 ,C接 , 接F。
(2)写出B电极上发生的电极反应式: ;
G试管中淀粉KI溶液变化的现象为 ,
相应的离子方程式是 。
(3)为精确测定电极上析出的铜的质量,所必需的实验步骤的先后顺序应是 。(选填下列操作步骤的编号)
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后的电极 ④低温烘干电极后称量
⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算式:NA= 。