从含镁、钾盐湖水中蒸发最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O),它在空气中极易潮解、易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:

①准确称取11.100g样品溶于水,配成l00.00mL溶液。
②取25.00mL溶液,加入NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 580g。
③另取25.00mL溶液,加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g。
(1)步骤②中检验沉淀完全的方法是 。
(2)若步骤③中为了加快干燥速度,置于阳光直射下干燥沉淀,结果出现沉淀变黑。测得光卤石结晶水含量将 (填“偏高”、或“偏低”或“不变”)。
(3)通过计算确定样品的组成(写出计算过程)。
标准状况下,22.4LHCl气体溶于50mL水再配成250mL溶液,求:
(1)所得盐酸的物质的量浓度为 ;
(2)若将此溶液再稀释成1L溶液,则稀释后盐酸的物质的量浓度变为 ;
(3)将(2)的溶液取出250mL与足量Zn反应可以产生的H2在标准状况下的体积为 。
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:
__________________________________________________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为____________________。与MnO2Zn电池类似,K2FeO4Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_____________________,该电池总反应的离于方程式为__________________________。
0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式______________。
(2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为_______________________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为____________,其存在的最高温度是________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为______________________________________________________
工业上用含锌物料(含FeO、CuO等杂质)可制得活性ZnO,流程如下:
(1)上述流程中,浸出用的是60%H2SO4(1.5 g·cm-3),配制这种H2SO4 100 mL需要18.4 mol·L-1的浓H2SO4________ mL(保留一位小数)。
(2)加入氧化剂H2O2后,有Fe(OH)3沉淀出现,没有Cu(OH)2沉淀出现,若溶液中c(Fe3+)=2.6×10-18 mol·L-1,则溶液中c(Cu2+)的取值范围是________mol·L-1。(已知Ksp[Fe(OH)3]=2.6×10-39,
Ksp[Cu(OH)2]=2.2×10-20)
(3)加入NH4HCO3后生成的沉淀是形态均为Zna(OH)b(CO3)c(a、b、c为正整数)的两种碱式碳酸锌A和B的混合物,A中a=5、b=6,则生成碱式碳酸锌A的化学方程式为__________________________________________________。
(4)取洗涤、烘干后的碱式碳酸锌A和B的混合物49.70 g,其物质的量为0.10 mol,高温焙烧完全分解得到37.26 g ZnO、3.584 L CO2(标准状况下)和水,通过计算求出碱式碳酸锌B的化学式。
将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X。
(1)写出碳酸氢钠分解产生的气体分别与过氧化钠反应的化学反应方程式:
_________________、_________________________。
(2)残余固体X的成分是____________。
| A.Na2O2、NaOH | B.Na2O2、Na2CO3 | C.NaOH、Na2CO3 | D.Na2O2、NaOH、Na2CO3 |
(3)向固体X中逐滴加入1mol/L的稀盐酸至不再产生气泡为止,产生的气体在标准状况下的体积为____L。请以V(HCl)为横坐标,V(CO2)为纵坐标,画出产生CO2的体积和加入稀盐酸溶液体积的关系。
硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。
I尾气的吸收和综合利用。
以工业制硫酸的尾气、氨水、石灰石、焦炭、碳酸氯铵和KCI为原料可以合成硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下: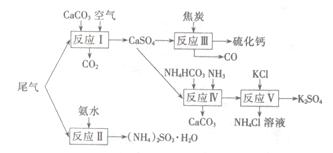
(1)反应III中氧化剂与还原剂的物质的量之比为 。
(2)反应Ⅳ的化学方程式为 。
(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为 。
Ⅱ催化剂的回收利用。
SO2的催化氧化所使用的催化剂为V2O5,实际生产中,催化剂在使用一段时间后,会含有V2O5、VOSO4和SiO2等,其中VOSO4。能溶于水。回收V2O5,的主要流程如下: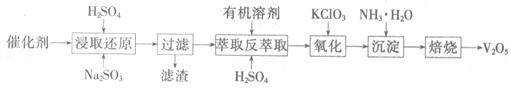
(4)若反萃取使用的硫酸用量过大,进一步处理时会增加____ 的用量。
(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为 。
氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为 。
某同学按下列步骤配制500mL 0.200mol/L KCl 溶液:
①将烧杯中的溶液转移至500mL 容量瓶中 ②称量KCl 固体 ③向容量瓶中加蒸馏水至刻度线 ④计算所需KCl的质量 ⑤将KCl加入100mL 烧杯中,并加适量水
(1)④计算所需要KCl 的质量为 ;
(2)实验的先后顺序应为 (填写序号);
(3)在 ①实验中,为防止溶液溅出,应采取的措施是 ;
(4)在进行 ③的实验操作时应注意的问题是 ;
(5)在进行 ⑤时,为了加快溶解速率,可以采取的措施是 .
(6)配制溶液时,下列实验操作会使配制溶液浓度偏高的是
| A.容量瓶内有水,未经过干燥处理 |
| B.定容时,俯视刻度线 |
| C.移液完成后,溶解KCl的烧杯未用蒸馏水洗涤 |
| D.定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |
汽车发生强烈碰撞时,安全气囊内的NaN3发生化学反应生成氯化钠(Na3N)与氮气,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
(1)请写出上述反应方程式: ;它的基本反应类型是 。
(2)若安全气囊内含有195gNaN3,其物质的量为 。
(3)若195gNaN3完全分解,在标准状况下,气囊膨胀的体积约为 。
(4)28gKOH固体必须溶解在 g水中,才能使每200个水分子中有1个K+。
(5)Mg能在O2、N2、CO2中燃烧,写出镁在CO2中燃烧的化学方程式 。
(1)13.2g氮的氧化物(NxO)中氧原子物质的量为0.3mol,该质量的NxO在标况下的体积为__________L,x的值为_________。
(2)化合物A的分子组成可用NxHy表示,在一定条件下可发生分解反应,15mLA气体完全分解生成5mL N2和20mL NH3(同温、同压)。A的化学式为_________________。
(3)20mL Al2(SO4)3溶液加水稀释至100mL,稀释后的溶液中SO42-的物质的量浓度为0.3mol∙L-1。则稀释前Al2(SO4)3的物质的量浓度为________________。
(1)0.5 mol H2O的质量为 ,其中含有 个水分子,共有 个原子。
(2)在下列提供的试剂中,选择合适的试剂除去下表中各混合物的杂质(括号内物质为杂质),并按要求填写空格。
| A.NaOH溶液 | B.稀盐酸 | C.氯水 | D.溴水 |
| 混合物(括号内为杂质) |
除杂试剂(填序号) |
反 应 离 子 方 程 式 |
| ① Cu (CuO) |
|
|
| ② NaBr (NaI) |
|
|
某同学用锌铜合金粉末与等体积、等浓度的稀硫酸分别做多次实验,现列出其中四组数据,请仔细阅读,回答有关问题:
| 实验编号 |
锌铜合金质量/g |
硫酸/mL |
硫酸锌/g |
| 1 |
2.0 |
56 |
4.83 |
| 2 |
3.0 |
56 |
|
| 3 |
4.0 |
56 |
9.66 |
| 4 |
5.0 |
56 |
9.66 |
(1)上表中空缺的数据应为_______________;
(2)从上面的数据可以判断实验____________(编号)是恰好完全反应。
(3)实验1中可选用_____________(物质名称)作为已知条件,计算放出氢气的体积是___________mL(标准状况)。
(4)锌铜合金中锌的质量分数为_____________。
(共18分)
(1)在同温同压下,等质量的CO和CO2,其体积之比为 ,电子数之比为 ,密度之比为 。
(2)9.5gMgCl2固体溶于水配成500mL溶液,其浓度为 mol·L-1,从中取出100mL溶液,其中Cl-的浓度为 mol·L-1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为 mol·L-1。
(3)某金属氯化物MCl2 27g ,含有0.40molCl-,则该氯化物的物质的量为_ _____,摩尔质量为 ,金属M的相对原子质量为 。
(每空1分,共15分)利用“化学计量在实验中的应用”的相关知识进行填空
(1)0.2 mol NH3气体中含的NH3分子数是 ,其中含氢原子数是 ,含有电子的物质的量是 .
(2)1摩尔Ba(OH)2固体中含有的Ba2+的个数是 ,全部溶于水,电离产生的OH-的物质的量是 mol,通入二氧化碳气体,恰好完全反应,消耗的二氧化碳的物质的量是 摩尔。
(3)H2SO4的摩尔质量是 ,49gH2SO4中含有 mol氧原子,含有氢的质量是 。能与 摩尔NaOH恰好完全反应,生成水的质量是 克。
(4)含有6.02×1023个氧原子的H3PO4的物质的量是_________
(5)与标准状况下VLCO2所含氧原子数目相同的水的质量是_______(用分式表示)
(6)将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为__________________
(7)在一定的温度和压强下,1体积X2 (g)跟3体积Y2 (g)化合生成2体积化合物,则该化合物的化学式是_______________