物质的量浓度相同的下列溶液:①Na2CO3②NaHCO3③H2CO3④(NH4)2CO3⑤NH4HCO3,按c(CO32-)由小到大排顺序正确的是( )
| A.⑤<④<③<②<① | B.③<⑤<②<④<① |
| C.③<②<⑤<④<① | D.③<⑤<④<②<① |
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量的CuSO4溶液,如各图中产生H2的体积V(L)与时间t(min)的关系,正确的是 
将0.2 mol MnO2和50mL 12mol/L盐酸混合后加热使其充分反应,反应完全后,向反应后的溶液中加入足量的AgNO3溶液 ,生成AgCl沉淀的物质的量是(不考虑盐酸的挥发)
| A.小于0.3mol | B.等于0.3mol |
| C.大于0.3mol,小于0.6mol | D.等于0.6mol |
由K2SO4、Al2(SO4)?3、KAl(SO4)?2·12H2O及H2SO4组成的混合溶液测得c(H+)?=0.1mol·L-1,c(Al 3+)="0.2" mol·L-1,c(SO42-)?="0.5" mol·L-1,则c(K+)为( )
| A.0.2 mol·L-1 | B.0.3 mol·L-1 | C.0.4 mol·L-1 | D.0.5 mol·L-1 |
下列说话正确的是( )
| A.标准状况下,1mol H2O所占有的体积约为22.4升 |
| B.含有2mol氧原子的氧单质在标准状况下占有的体积一定是22.4升 |
| C.有单质参加或生成的化学反应一定是氧化还原反应 |
| D.同温同压下,2L二氧化碳气体和3L一氧化碳气体所含有的原子数目相等 |
下列说法,你认为不可能的是
| A.只用米汤就可以鉴定食盐是否加碘 | B.一滴水中的分子数比全球人口还多 |
| C.汽车尾气中含有氮的氧化物 | D.可口可乐pH=2.2 |
下列各组有机物,无论它们以何种物质的量的比例混合,只要总物质的量一定,则在完全燃烧时,消耗O2的量为一恒定值的是
| A.C5H10和C6H8 | B.C2H6和C3H8 | C.C3H6和C3H8O | D.C2H6O和C2H4O2 |
分子中含有若干个双键的烯烃的摩尔质量为M,Wg该烯烃与标况下的V L H2恰好反应,1mol该烃的双键数目为(NA为阿伏加德罗常数)
A. |
B.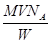 |
C.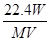 |
D. |
在只含有Na+、Al3+、Cl-、SO42-四种离子的溶液中(不考虑H+、OH-),已知Na+,Al3+,SO42-的物质的量浓度分别为0.2 mol/L,0.1 mol/L,0.1 mol/L,则溶液中 Cl-的物质的量浓度为 ( )
| A.0.1 mol/L | B.0.2 mol/L | C.0.3 mol/L | D.0.4 mol/L |
下列说法正确的是 ( )
| A.物质的量可以理解为物质的质量 |
| B.物质的量就是物质的粒子数目 |
| C.物质的量是量度物质所含微观粒子多少的一个物理量 |
| D.物质的量的单位——摩尔只适用于分子、原子和离子 |
右图表示相同质量的Mg、Al分别跟一定量相同浓度的稀H2SO4溶液反应的情况,
下列叙述可能符合图示的有
| A.Mg、Al均过量 |
| B.Mg、Al均不足,硫酸过量 |
| C.Ⅱ表示Mg与稀H2SO4反应 |
| D.产生氢气的速率是Ⅰ大于Ⅱ |
只给出下列甲和乙中对应的物理量,能求出物质的量的是
| A.甲:物质中的粒子数;乙:阿伏加德罗常数 |
| B.甲:标准状况下的气体摩尔体积;乙:标准状况下的气体的体积 |
| C.甲:固体的体积;乙:固体的密度 |
| D.甲:溶液中溶质的物质的量浓度;乙:溶液体积 |
将Cu片放入0.l mol / L FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
| A.3 : 2 | B.3 : 5 | C.4 : 3 | D.3 : 4 |
.将5 mol·L-1盐酸10 mL稀释到200 mL,再取出5 mL,这5 mL溶液的物质的量浓度是
| A.0.05 mol·L-1 | B.0.25 mol·L-1 |
| C.0.1 mol·L-1 | D.0.5 mol·L-1 |
下列溶液中物质的量浓度为1 mol·L-1的是
| A.将40 g NaOH溶解于1 L水中 |
| B.将22.4 L氨气溶于水配成1 L溶液 |
| C.将1 L 10 mol·L-1的浓盐酸与9 L水混合 |
| D.将10 g NaOH溶解在水中配成250 mL溶液 |