设NA表示阿伏加德罗常数,下列说法正确的是
| A.1mol丙烯酸含有NA个不饱和键 |
| B.标准状况下,11.2L的苯中含有3NA个碳氢键 |
| C.0.1mol/L的Na3PO4溶液中含有的阴离子总数大于0.1NA |
| D.1L1.0mol/L的Na2SiO3溶液中含有的氧原子数目大于3NA |
用密度为1.84g/mL,质量分数为98%的浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释 ④转移 ⑤洗涤 ⑥定容 ⑦摇匀
(1)所需浓硫酸的体积是 。
(2)第③步实验的操作是 。
(3)第⑥步实验的操作是 。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用字母填写a.偏高 b.偏低 c.无影响)
| A.所用的浓硫酸长时间放置在密封不好的容器中 |
| B.容量瓶用蒸馏洗涤后残留有少量的水 |
| C.所用过的烧杯、玻璃棒未洗涤 |
| D.量取浓硫酸时仰视量筒上的刻度取用浓硫酸 |
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(5)本实验最浪费时间的地方是将稀释后的硫酸冷却至室温,为了节约时间,简单易行的加
快稀硫酸冷却的方法是_____________________。
下列各组数据中,前者刚好是后者两倍的是( )
| A.2 mol水的摩尔质量和1 mol水的摩尔质量 |
| B.200 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-) |
| C.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度 |
| D.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数 |
在相同的温度和压强下,二氧化碳和笑气(化学式为N2O)的体积相同,则下列它们的( )一定相同。
(1)分子数 (2)原子数 (3)密度 (4)质量 (5)物质的量
| A.只有(1)(5) | B.只有(1)(2)(4)(5) |
| C.只有(2)(3)(4)(5) | D.(1)(2)(3)(4)(5) |
设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
| A.标准状况下,2.24LCH4所含质子数为0.1NA |
| B.0.1mol Fe与足量氯气反应转移的电子数为0.2NA |
| C.0.1mol C8H18分子中共价键总数为2.5NA |
| D.100mL 1mol/L醋酸溶液中离子总数为0.2NA |
将a g 铁棒插入100ml CuSO4溶液中,一段时间后取出,洗净、干燥、称量为 b g ,则反应后溶液中FeSO4的物质的量浓度为(忽略溶液体积变化)
| A.(b-a)/ 8 mol/L | B.(a-b)/ 8 mol/L | C.5(b-a)/ 4 mol/L | D.5(a-b)/ 4 mol/L |
下列溶液中物质的量浓度肯定是1mol/L的是( )
| A.将40gNaOH固体溶解于1L水中 |
| B.将22.4L氯化氢气体溶于水配成1L溶液 |
| C.将1L10mol/L浓盐酸与10L水混合 |
| D.10gNaOH固体溶解在水中配成250mL溶液 |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A.标准状况下,22.4LH2O含有的分子数为1 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C.通常状况下,1 NA 个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol·/L的MgCl2溶液中,含有Cl-个数为1 NA |
某同学利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略):
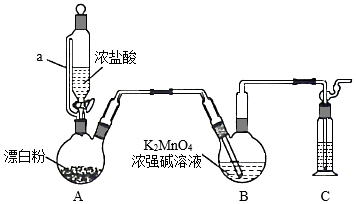
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO42﹣+2H2O═2MnO4﹣+MnO2↓+4OH﹣
回答下列问题:
(1)装置A中a的作用是 ;装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入 酸式 (填“酸式”或“碱式”)滴定管中;在规格为50.00 mL的滴定管中,若KMnO4溶液起始读数为15.00 mL,此时滴定管中KMnO4溶液的实际体积为 (填标号)。
A.15.00 mL B.35.00 mL C.大于35.00 mL D.小于15.00 mL
(4)某FeC2O4•2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4•2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.称取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃.用c mol•L﹣1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2 mL。
样品中所含H2C2O4•2H2O(M=126g•mol﹣1)的质量分数表达式为 。
下列关于样品组成分析的说法,正确的是 (填标号)。
A. 3时,样品中一定不含杂质
B. 越大,样品中H2C2O4•2H2O含量一定越高
C.若步骤Ⅰ中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A.常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA |
| B.标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
| C.92 g NO2和N2O4的混合气体中含有的原子总数为6NA |
| D.100g 17%的氨水,溶液中含有的NH3分子数为NA |
汽车发生强烈碰撞时,安全气囊内的NaN3发生化学反应生成氯化钠(Na3N)与氮气,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
(1)请写出上述反应方程式: ;它的基本反应类型是 。
(2)若安全气囊内含有195gNaN3,其物质的量为 。
(3)若195gNaN3完全分解,在标准状况下,气囊膨胀的体积约为 。
(4)28gKOH固体必须溶解在 g水中,才能使每200个水分子中有1个K+。
(5)Mg能在O2、N2、CO2中燃烧,写出镁在CO2中燃烧的化学方程式 。
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.87 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.316 |
158 |
| 硝酸银 |
0.075 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)硫酸钾在水中的电离方程式为______________________。
(3)配制1L上述“鲜花保鲜剂”所需的仪器有:量筒、玻璃棒、药匙、烧杯、__________、__________、_________。(在横线上填写所缺仪器的名称),需要高锰酸钾________mol
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为_______ mol/L。
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A.200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA |
| B.1 mol -CH3和1 mol OH- 都含有10 NA个电子 |
| C.标准状况下3.36 L CCl4含碳原子数为0.15NA |
| D.1mol Na完全反应生成Na2O2时失去NA个电子 |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,11.2 L SO3所含的氧原子数为1.5NA |
| B.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA |
| C.常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA |
| D.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
(1)相同质量的CO 和CO2所含分子的数目之比为 ,原子的物质的量之比为 ,在同温同压下气体的体积之比是 。
(2)100mL Al2(SO4)3溶液中c(SO42-)=0.9mol/L,则c(Al3+)= mol/L,n[Al2(SO4)3]= mol。
(3)已知8g A能与32g B恰好完全反应,生成22gC和一定量D,现将16g A与足量B的混合物充分反应后,生成2mol D和一定量的C,则D的摩尔质量为 。
(4)若1g N2中含有x个原子,则阿伏加德罗常数NA= 。(用所给数字及符号填空)
(5)将钠和铝的混合物0.2mol溶于足量的盐酸中,产生3136mL(标准状况)氢气,则钠和铝的物质的量之比为 。