用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是
| A.该反应在任何温度下可自发进行 |
| B.若混合气体的总质量不变,表明上述反应己达到平衡状态 |
| C.其他条件不变,增大Si3N4的物质的量,平衡向左移动 |
| D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低 |
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在___(填"T1”、“T2”.,“T3”)温度下反应达到平衡所需时间最长:
假设温度为T1时向该反应容器中同时加入。(SiC14) =0.3 mol/L,c(H2) =0.3 mol/L,,c(N2) =
x mol/L, c (HCl) =0.3 mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值
范围为___
(4)该反应的原子利用率为____
(5)工业上制备SiCl4的反应过程如下:
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiC14和一氧化碳的热化学方程式_____
分1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的。现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示: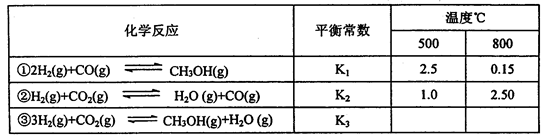
(1)反应②是____________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。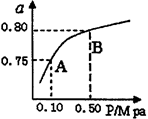
据反应①与②可推导出K1、K2与K3之间的关系,则K3=_________(用K1、K2表示
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如下图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,
以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是_________________;
(5)一定条件下甲醇与一氧化碳反应可以合成醋酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_____________。
I.已知:C(s)+H2O(g) CO(g)+H2(g) ΔH
CO(g)+H2(g) ΔH
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100 kPa |
4.56 |
5.14 |
5.87 |
6.30 |
7.24 |
8.16 |
8.18 |
8.20 |
8.20 |
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变 B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变 D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s) ΔH=ax kJ/mol ①
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s) ΔH=bx kJ/mol。 ②
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是 。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。试分析: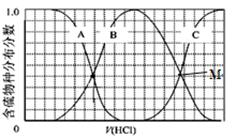
①B曲线代表 分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)= 。
②M点,溶液中主要涉及的离子方程式 。
硫酸工业在国民经济中占有极其重要的地位。请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 郊
区(填标号);
| A.有丰富黄铁矿资源的城市 | B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 | D.人口稠密的文化、商业中心城市 |
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,
该反应的化学方程式为 。
(3)为提高SO3吸收率,实际生产中通常用 吸收SO3。
(4)已知反应2SO2+O2 SO3 △H <0,现将0.050mol SO2和0.030mol O2
SO3 △H <0,现将0.050mol SO2和0.030mol O2
充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压
强缩小到原来压强的75%,则该条件下SO2的转化率为________;该条件下的
平衡常数为__________。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在
沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
| 炉渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随
温度升高而降低的原因 。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方
法可用 (填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产
水泥的辅料,写出这两步反应的化学方程式 。
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s);△H =" -235.8" kJ/mol;
己知:2 Ag2O(s)===4Ag(s)+O2(g);△H = +62.2kJ/mol;
则反应 2O3(g)= 3O2(g) 的△H = kJ/mol;
②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产
生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为 。 (2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下:
(2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下: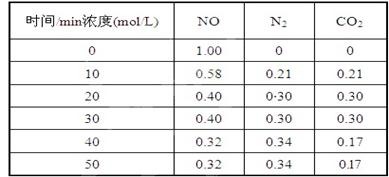
①在10 min~20 min的时间段内,以CO2表示的反应速率为 ;
②写出该反应的平衡常数的表达式K= ;
③下列各项能作为判断该反应达到平衡状态的是 (填序号字母);
| A.容器内压强保持不变 | B.2v正(NO)=v逆(N2) |
| C.容器内CO2的体积分数不变 | D.混合气体的密度保持不变 |
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是 ;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
Ⅰ.分类法是化学学习的一种十分有效的方法,它可以使我们从不同角度对同一知识做更加深入的了解,人们根据不同的标准,即使同一物质也可能被划在不同的类别中。现有如下物质①MgCl2②HCl ③SO2 ④ NO2 ⑤K2CO3 ⑥ Cl2 ⑦CaO ⑧ NaOH
请根据下列标准,对上述物质进行分类:
(1)既含离子键又含共价键的物质是 (填代号,下同)。
(2)只含共价键且为非电解质的是 。
(3)含有共价键的化合物是 。
Ⅱ.向某恒容的密闭容器中加入A、B、C三种气体,如图所示是一定条件下三种气体的物质的量随时间的变化情况。
(1)写出该密闭容器发生反应的化学方程式为 。
(2)2分钟后A、B、C各物质的量不再随时间的
变化而变化,其原因是____ 。
(3)下列情况能说明该反应达到化学反应限度的是 。
A.该容器的压强不再发生变化;
B.单位时间内生成A的物质的量与生成C的物质的量相同;
C.该容器中气体的密度不再改变;
D.容器中A的物质的量与C的物质的量相同
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 |
化学方程式 |
焓变 |
活化能 |
| 甲烷氧化 |
-802.6 |
125.6 |
|
| -322.0 |
172.5 |
||
| 蒸汽重整 |
206.2 |
240.1 |
|
| 165.0 |
243.9 |
回答下列问题:
(1)反应的
=kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP=;
CO(g)+3H2(g)的KP=;
随着温度的升高,该平衡常数(填"增大"、"减小"或"不变")。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于。
(5)在某一给定进料比的情况下,温度、压强对和
物质的量分数的影响如下图:

①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是。
A.600℃,0.9Mpa B. C.
D.
②画出条件下,系统中
物质的量分数随反应时间(从常温进料开始即时)
的变化趋势示意图:

(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
求:(1)平衡时A的物质的量浓度; (2) B的转化率;(3) x的值。(要求写出计算过程)
已知:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为 ,该反应的Q 0。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反应速率v(CO)= 。
(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020mol/L,该条件下,CO的最大转化率为 。
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x平衡时CO的转化率为y,试推导y随x变化的函数关系式为 。
(5)某电化学装置可实现2CO2=2CO+O2的转化,使CO重复使用。已知该反应的阳极应为4OH--4e-=2H2O+O2,则阴极反应式为 。
(6)有人提出可以设计反应2CO=2C+O2(ΔH>0)来消除CO的污染,请判断上述反应能否发生 (填“可能”或“不可能”),理由是 。
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
| A.减少NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)已知在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为:__________。
(6)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,2C(s)+O2(g) =2CO(g) △H= 。

(2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H2,一定
条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如右图所示:
①从反应开始到平衡,H2O的平均反应速率v(H2O)= 。
②下列措施中能使化学平衡向正反应方向移动的是 (填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入l mol CO2和4 mol H2
(3) CO2溶于水生成碳酸。已知下列数据:
| 弱电解质 |
H2CO3 |
NH3.H2O |
| 电离平衡常数( 25℃) |
Ka1=" " 4.30 × 10一7 Ka2=" " 5.61× 10一11 |
Kb = 1.77× 10一5 |
现有常温下1 mol·L-1的( NH4)2CO3溶液,已知:NH4+水解的平衡常数Kh=Kw/Kb,
CO32-第一步水解的平衡常数Kh=Kw/Ka2。
①判断该溶液呈 (填“酸”、“中”、 “碱”)性,写出该溶液中CO32-
发生第一步水解的离子方程式 。
②下列粒子之间的关系式,其中正确的是 。
A.c(NH4+)>c(HCO3-)> c(CO32-)>(NH4+)
B.c(NH4+)+c(H+)= c(HCO3-)+c(OH-)+ c(CO32-)
C. c(CO32-)+ c(HCO3-)+c(H2CO3)=1mol/L
D. c(NH4+)+ c(NH3.H2O)="2" c(CO32-)+ 2c(HCO3-) +2c(H2CO3)
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特
殊电极材料以CO和O2为原料做成电池。原理如图所示:通入CO的管口是 (填“c”或“d”),写出该电极的电极反应式: 。
含硫化合物在工业生产中有广泛的用途。
(1)SO2可用于工业生产SO3。
①在一定条件下,每生成8g SO3气体,放热9.83kJ。该反应的热化学方程式为________。
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2 mol SO2和1 mol O2。甲保持压强不变,乙保持容积不变,充分反应后均达到平衡。
I.平衡时,两容器中SO3体积分数的关系为:甲_______乙(填“>”、“<”或“ =”)。
II.若乙在t1 min时达到平衡,此时测得容器乙中SO2的转化率为90%,则该
反应的平衡常数为_______;保持温度不变,t2 min时再向该容器中充入1 mol SO2和1 mol SO3,t3min时达到新平衡。请在下图中画出t2~t4 min内正逆反应速率的变化曲线(曲线上必须标明V正、V逆 )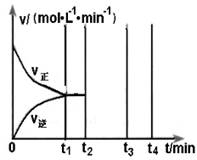
(2)硫酸镁晶体(MgSO4·7H2O )在制革、医药等领域均有广泛用途。4.92g硫酸镁晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如右图所示。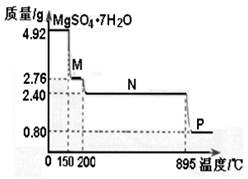
①固体M的化学式为__________。
②硫酸镁晶体受热失去结晶水的过程分为_________个阶段。
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为_________。
(14 分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K= 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H="-566.0" kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H= ;
2CO(g)+2H2(g) 的△H= ;
③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是 ;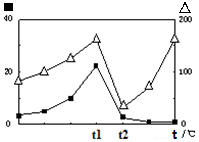 (∆代表CO的生成速率,■代表催化剂的催化效率)
(∆代表CO的生成速率,■代表催化剂的催化效率)
④为了提高该反应中CH4的转化率,可以采取的措施是 ;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向 (填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式: ;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为 。
氢气是一种清洁能。用甲烷制取氢气的两步反应的能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为 ,随着温度升高该反应的化学平衡常数的变化趋势是 。
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是_______(填序号)。
a.四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b. 单位时间内断开amol H-H键的同时断开2a mol O-H键
c. 反应容器中放出的热量不再变化
d. 混合气体的密度不再发生变化
e. 混合气体的压强不再发生变化
(4)某温度下,第II步反应的平衡常数为K=1/9。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是 。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2O)/ mol/L |
0.010 |
0.020 |
0.020 |
| c(CO)/ mol/L |
0.010 |
0.010 |
0.020 |
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2O的转化率均是25%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D. 平衡时,乙中H2O的转化率大于25%
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。
(1)汽车内燃机工作时发生反应:N2(g) + O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
①5 min内该反应的平均速率υ (NO) = ;在T ℃时,该反应的平衡常数K = 。
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是 (填序号)。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g) + O2(g) = 2NO(g) ΔH =" +180.5" kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) ΔH =" -571.6" kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是 。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g) 2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的ΔH 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在下图中画出c(NO) 在T1、 S2 条件下达到平衡过程中的变化曲线。