以化学反应原理为依据,以实验室研究为基础,可以实现许多化工生产。
I分解水制取氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应:
分析上述反应,下列判断正确的是____。
循环过程中产生1 的同时产生
的同时产生
反应①中 还原性比
还原性比 强
强
循环过程中需补充
反应③易在常温下进行
在一定温度下,向2L密闭容器中加入 ,发生反应②.物质的量随时间的变化如图所示。
,发生反应②.物质的量随时间的变化如图所示。 内的平均反应速率
内的平均反应速率
 的转化率=_______
的转化率=_______
恒温恒容条件下,硫发生转化的反应过程和能量关系如图所示。 请回答下列问题:
请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式_______;
②恒温恒容时, 和
和 充分反应,放出热量的数值比
充分反应,放出热量的数值比 _____(填“大”、“小”或“相等”)
_____(填“大”、“小”或“相等”)
II.氮化硅( )是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
)是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
该反应平衡常数的表达式为K=_______.升高温度,其平衡常数
_________(填“增大”、“减少”或“不变”)。
(2)该化学反应速率与反应时间的关系如图所示
 时引
时引 起突变的原因是_____,
起突变的原因是_____, 引起变化的因素是_____,
引起变化的因素是_____, 时引
时引 小变化、
小变化、 大变化的原因是_________.
大变化的原因是_________.
【改编】(15分)2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为: ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
ΔH<0。在一定温度下,在一个体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是 。
| A.在单位时间内生成1mol CO2的同时消耗了lmol CO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在下图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
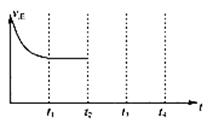
③若要同时提高该反应的速率和NO的转化率,采取的措施有 、 。(写出2个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应C(g) + H2O(g)  CO(g) + H2(g) ΔH=+131.3kJ·mol-1
CO(g) + H2(g) ΔH=+131.3kJ·mol-1
①该反应在 下能自发进行(填“高温”或“低温”)。
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为 。[已知:Ka1(H2S)=9.1×10-8,Ka2(H2S)=1.1×10-12;Ka1(H2CO3)=4.3×10-7, Ka2(H2CO3)=5.6×10-11]
(3)已知反应:CO(g)+H2O(g) CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需的时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1条件下平衡常数K= (保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是 。
③该反应的ΔH 0 (填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO、5mo1 H2O、2mo1 CO2、5mol H2,则此时v(正) v(逆)(填“<”、“>”或“=”)。
【改编】甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景。
(1)已知:①2CH3OH(l) + 3O2(g) 2CO2(g) + 4H2O(g) △H=-1275.6 kJ•mol-1
2CO2(g) + 4H2O(g) △H=-1275.6 kJ•mol-1
②2CO(g) + O2(g) 2CO2(g) △H=-566.0 kJ•mol-1
2CO2(g) △H=-566.0 kJ•mol-1
③H2O(l) = H2O(g) △H =" +" 44.0 kJ•mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
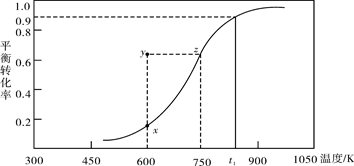
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是______________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式 。
已知:①CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
②C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。

②某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是 ;

A.P3>P2,T3>T2 B.P1>P3,T1>T3
C.P2>P4,T4>T2 D.P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ;
A.正反应速率先增大后减小
B.逆反应速率先增大后减小
C.化学平衡常数K值增大
D.反应物的体积百分含量增大
E.混合气体的密度减小
F.氢气的转化率减小
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式__ 。以此燃料电池作为外接电源按图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 g。

在一定体积的密闭容器中,进行如下反应:A(g) B(g)+C(g),其化学平衡常数K和温度t的关系如下表所示:
B(g)+C(g),其化学平衡常数K和温度t的关系如下表所示:
| toC |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K= 。
(2)在下图中用实线画出该反应的能量变化曲线,同时在此基础上用虚线画出加入催化剂后的能量变化曲线。

(3)一定温度和体积下,下列说法中能说明该反应达平衡状态的是 。
①容器内压强不变
②混合气体中c(C)不变
③混合气体的密度不变
④v(A)=v(B)
⑤化学平衡常数K不变
⑥混合气体平均式量不变
(4)反应时间(t)与容器内气体A的浓度数据见下表
| 时间t/min |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
| C(A)/(mol·L-1) |
10.4 |
8.6 |
7.5 |
6.6 |
5.9 |
5.5 |
5.5 |
回答下列问题:
①2~4min内,B的平均速率为 。
②反应达平衡时,A的转化率为 。
③欲提高A韵平衡转化率,可以采取的措施有 。
(15分)二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 。
(4)将合成气以n(H2)/n(CO)=2通入1L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
A.△H<0
B.P1<P2<P3
C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 。

(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
(17分)金属镍具有优良的物理和化学特性,是高技术产业的重要原料。
(1)羰基法提纯镍涉及的反应为:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
①当温度升高时,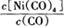 减小,则H 0(填“>”或“<”)。
减小,则H 0(填“>”或“<”)。
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填代号)。

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=____mol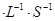 。
。
③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为____________________(写出一条措施即可)。
(2)以NiS04溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼,下列说法正确的是____________(填代号)。(已知氧化性: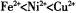 )
)
a.电解过程中,化学能转化为电能
b.粗镍作阳极,发生还原反应
c.利用阳极泥可回收Cu、Pt、Au等金属
d.粗镍精炼时通过的电量与阴极析出镍的质量成正比
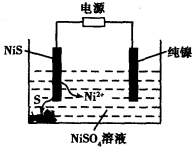
(3)工业上用硫化镍(NiS)作为电极材料冶炼镍。电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,镍元素以Ni2+形态进入电解液中,如图所示。硫化镍与电源的____________(填“正极”或“负极”)相接。写出阳极的电极反应式________________。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g) +O2(g)=H2O(g)+CO2(g),ΔH=____ ___kJ/mol。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。A、B两点的平衡常数K(A)_______K(B)(填“>”、“=”或“<”,下同);由图判断ΔH _____0。
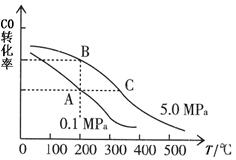
③某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)。
(3)工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。
【改编】氨气在科研、生产中有广泛应用。
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g) 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。

①实验Ⅲ在前10分钟内NH3平均反应速率v(NH3)= ;
②与实验Ⅱ相比,实验Ⅲ采用的实验条件可能为 。
③K(T1)___K(T2)(填“>”、“=”或“<”)。
④下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。

(2)常温下NH3•H2O的电离平衡常数Kb=1.8×10-5 mol·L-1,则反应NH4+(aq)+H2O(l) NH3•H2O(aq)+H+(aq)的化学平衡常数Kh= (保留三位有效数字)。
NH3•H2O(aq)+H+(aq)的化学平衡常数Kh= (保留三位有效数字)。
(3)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+ (g) ΔH2= 。
2012年8月24日,武汉市一家有色金属制造厂发生氨气泄露事故。已知在一定温度下,合成氨工业原料气H2制备涉及下面的两个反应:
C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
CO(g)+H2O(g) H2(g)+CO2(g)。
H2(g)+CO2(g)。
(1)判断反应CO(g)+H2O(g) CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
A.容器内压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g) 2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。

①若图中c=1.6 mol,则改变的条件是________(填字母);
②若图中c<1.6 mol,则改变的条件是__________(填字母);此时该反应的平衡常数____________。(填字母)(填“增大”、“减小”、“不变”)
A.升温
B.降温
C.加压
D.减压
E.加催化剂
(3)如(2)题中图甲,平衡时氢气的转化率为________。

(4)工业上可利用如下反应:H2O(g)+CH4(g) CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
(14分)尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s)
NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡气体总浓度 (10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①关于上述反应的焓变、熵变说法正确的是 。
A.∆H<0, ∆S<0 B.∆H>0, ∆S<0
C.∆H>0, ∆S>0 D.∆H<0, ∆S>0
②关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1 L0.1 mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052 mol氨基甲酸铵,此时溶液中几乎不含碳元素。此时溶液中c(NH4+ )= ;
NH4+ 水解平衡常数值为 。
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,写出该电池的负极反应式: 。
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+  O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
反应:Fe2O3(s)+ 3CO(g) 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ.反应 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
 Fe(s)+ CO2(g)在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
Fe(s)+ CO2(g)在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化(Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1 kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2 kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3 kJ热量 |
则下列关系正确的是________.
A.c1=c2
B.2Q1=Q3
C.2α1=α2
D.α1+α2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l mol CO、2mol H2和1mol CH3OH ,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向______(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式__________________ ____。
焦炭与CO、H2均是重要的能源,也是重要的化工原料。
(1)已知C、H2、CO的燃烧热(△H)分别为-393.5 kJ·mol-1、-285.8kJ·mol-1、-283 kJ·mol-1,又知水的气化热为+44 kJ/mol。
①焦炭与水蒸气反应生成CO、H2的热化学方程式为___________________。
②若将足量焦炭与2mol水蒸气充分反应,当吸收能量为191.7 kJ时,则此时H2O(g)的转化率为_________________。
(2)将焦炭与水蒸气置于容积为2L的密闭容器中发生反应:C(s)+H2O(g) CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。
CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。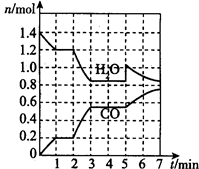
①第一个平衡时段的平衡常数是______________,若反应进行到2 min时,改变了温度,使曲线发生如图所示的变化,则温度变化为___________(填“升温”或“降温”)。
②反应至5 min时,若也只改变了某一个条件,使曲线发生如图所示的变化,该条件可能是下述中的____。
a.增加了C
b.增加了水蒸气
c.降低了温度
d.增加了压强
(3)假设(2)中反应在第2min时,将容器容积压缩至1 L,请在上图中绘制出能反映H2O、CO物质的量变化趋势的图像。
(4)若以CO、O2、K2CO3等构成的熔融盐电池为动力,电解400 mL饱和食盐水,则负极上的电极反应式为______________________,当有5·6g燃料被消耗时,电解池中溶液的pH=__________(忽略溶液的体积变化,不考虑能量的其它损耗)。
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
| 物质浓度 时间/min |
0 |
1 |
2 |
3 |
4 |
| CH4 |
0.2mol·L-1 |
0.13 mol·L-1 |
0.1 mol·L-1 |
0.1 mol·L-1 |
0.09 mol·L-1 |
| H2 |
0 mol·L-1 |
0.2 mol·L-1 |
0.3 mol·L-1 |
0.3 mol·L-1 |
0.33 mol·L-1 |
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。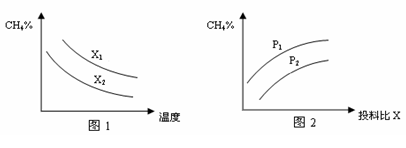
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
目前“低碳经济”备受关注。CO2的产生及有效开发利用成为科学家研究的重要课题。试利用所学知识,解决下列问题。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:_________________
它所对应的化学反应为:_________________
(2)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需的时间/min |
|
| C(s) |
H2O(g) |
H2(g) |
||||
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1.2 |
3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母).
A.=0.8mol•L﹣1 B.=1.4mol•L﹣1
C.<1.4mol•L﹣1 D.>1.4mol•L﹣1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母).
A.0.6mol、1.0mol、0.5mol、1.0mol
B.0.6mol、2.0mol、0mol、0mol
C.1.0mol、2.0mol、1.0mol、2.0mol
D.0.25mol、0.5mol、0.75mol、1.5mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[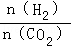 ] ] |
500K |
600K |
700K |
800K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=).
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 .若以1.12L•min﹣1(标准状况)的速率向该电池中通入甲醚(沸点为﹣24.9℃),用该电池电解500mL 2mol•L﹣1 CuSO4溶液,通电0.50min后,理论上可析出金属铜 g.