(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g) +O2(g)=H2O(g)+CO2(g),ΔH=____ ___kJ/mol。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。A、B两点的平衡常数K(A)_______K(B)(填“>”、“=”或“<”,下同);由图判断ΔH _____0。

③某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)。
(3)工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。

 G转化过程中,甲醛参与反应的化学方程式:_______________________________。
G转化过程中,甲醛参与反应的化学方程式:_______________________________。 它所对应的化学反应为: 。
它所对应的化学反应为: 。 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g) 2CO(g)+2H2(g)平衡体系中各组分的浓度为:
2CO(g)+2H2(g)平衡体系中各组分的浓度为:




 。
。 :______________________________________________。
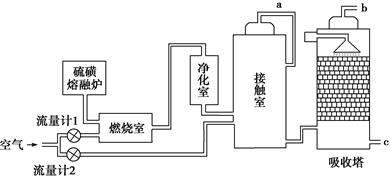
:______________________________________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号