天津市河东区高三一模理综化学试卷
化学与人类生产,生活密切相关。下列有关说法不正确的是
| A.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |
| B.福尔马林可浸制标本,利用了其使蛋白质变性的性质 |
| C.医用酒精使用淀粉类植物发酵经蒸馏制成,浓度通常为75% |
| D.绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物 |
下列关于元素及其化合物的说法,正确的是
| A.Fe在常温下可与浓硝酸,浓硫酸,稀硝酸发生剧烈反应 |
| B.碳酸氢钠可用于制备纯碱,治疗胃酸过多的药物,食品发酵剂 |
| C.通过丁达尔效应可以鉴别稀豆浆和氢氧化铁胶体 |
| D.根据某元素的质子数和中子数,可以确定该元素的相对原子质量 |
关于下列各实验的叙述中,不正确的是
| A.图①可用于实验室制备少量氯气或氨气 |
| B.可从a处加水的方法检验设置装置②的气密性 |
| C.实验室可用装置③收集HCl气体 |
| D.装置④可用苯萃取碘水中碘的操作,并把苯的碘溶液从漏斗上口放出 |
国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如图,说法正确的是
| A.分子式C15H21O4 |
| B.既能发生加聚反应,又能发生缩聚反应 |
| C.分子中有两个手性碳原子 |
| D.既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
下表是在相同温度下,三种酸的一些数据,下列说法正确的是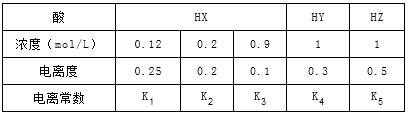
| A.相同温度下,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且K1>K2>K3=0.1 |
| B.室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)×c(OH-)]的比值变小,若加少量盐酸,则比值变大 |
| C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-) |
| D.相同温度下,K5>K4>K3 |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni),铁做电极电解浓氢氧化钠溶液制备Na2FeO4的装置如图,说法合理的是
| A.镍是阳极,电极反应4OH--4e-=2H2O+O2↑ |
| B.电解时电流方向:负极→镍电极→溶液→铁电极→正极 |
| C.若隔膜是阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低,阴极区pH升高,撤去隔膜后与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的三倍。
请用化学用语回答:
(1)丙在元素周期表中的位置___________________________
(2)丁单质的电子式___________________________________
(3)乙的两种常见单质分别是__________,_______________
(4)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)________,________
(5)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)__________。此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式_________________
(6)电解丁的钠盐饱和溶液的离子方程式________________________________
(7)若甲的元素符号为X。已知①X2(g)+2O2(g)==X2O4(l) △H="-19.5KJ/mol" ②X2H4(l)+O2(g)==X2(g)+2H2O(g) △H=-534.2KJ/mol则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式为______________________________________________________
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。
(1)A分子中的官能团名称是 、 。
(2)A的结构简式____________________
A的一种同分异构体属于乙酸酯,其结构简式是 。
(3)B转化为C的化学方程式是 ,其反应类型是 。
II.用烃C或苯合成PMLA的路线如下。
(4)1 mol有机物H与足量NaHC03溶液反应生成标准状况下的C02 44.8L,H有顺反异构,其反式结构简式是 。H的核磁共振氢谱有______种峰(反式结构)。
(5)E的结构简式是 。
(6)G与NaOH溶液在加热条件下反应的化学方程式是 。
(7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种) 。
I.实验室常见的几种气体发生装置如图A、B、C所示。
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气,化学反应方程式________________
(2)气体的性质是选择气体收集方法的主要依据,下列性质与收集方法无关的是(填序号,下同)______
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X气体可以是下列气体中的_________
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中D装置中连接小烧杯的目的是_______________。
II.某小组以COCl2·6H2O,NH4Cl,H2O2,浓氨水为原料,在活性炭催化下,合成橙黄色晶体X。为确定其组成,进行如下实验。
(4)经测定,样品X中钴,氨,氯的物质的量之比为1:6:3,钴的化合价为_________
已知X的化学式类似于下列化学式:
氢氧化二氨合银Ag(NH3)2OH 、硫酸四氨合铜[Cu(NH3)4]SO4制备X的化学方程式_____________________
(5)氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mL c1mol·L-1的盐酸标准溶液吸收,蒸氨结束后取下接收瓶,用c2mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mL NaOH溶液。
①放⑤(盐酸标准液)的仪器名称______________________
②装置中安全管的作用原理______________________________
③样品中氨的质量分数表达式____________________________
目前“低碳经济”备受关注。CO2的产生及有效开发利用成为科学家研究的重要课题。试利用所学知识,解决下列问题。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:_________________
它所对应的化学反应为:_________________
(2)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需的时间/min |
|
| C(s) |
H2O(g) |
H2(g) |
||||
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1.2 |
3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母).
A.=0.8mol•L﹣1 B.=1.4mol•L﹣1
C.<1.4mol•L﹣1 D.>1.4mol•L﹣1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母).
A.0.6mol、1.0mol、0.5mol、1.0mol
B.0.6mol、2.0mol、0mol、0mol
C.1.0mol、2.0mol、1.0mol、2.0mol
D.0.25mol、0.5mol、0.75mol、1.5mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[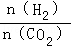 ] ] |
500K |
600K |
700K |
800K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=).
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 .若以1.12L•min﹣1(标准状况)的速率向该电池中通入甲醚(沸点为﹣24.9℃),用该电池电解500mL 2mol•L﹣1 CuSO4溶液,通电0.50min后,理论上可析出金属铜 g.
 粤公网安备 44130202000953号
粤公网安备 44130202000953号