新的研究表明二甲醚(DME)是符合中国能源结构特点的优良车用替代燃料,二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):
①CH3OCH3(g) + H2O(l)  2 CH3OH(l) △H=+24.52kJ/mol
2 CH3OH(l) △H=+24.52kJ/mol
②CH3OH(l) + H2O(l)  CO2(g) + 3H2(g) △H=+49.01kJ/mol
CO2(g) + 3H2(g) △H=+49.01kJ/mol
③CO(g) + H2O(l)  CO2(g) + H2(g) △H=-41.17kJ/mol
CO2(g) + H2(g) △H=-41.17kJ/mol
④CH3OH(l)  CO (g) + 2H2(g) △H=+90. 1kJ/mol
CO (g) + 2H2(g) △H=+90. 1kJ/mol
请回答下列问题:
(1)写出用二甲醚制H2同时全部转化为CO2时反应的热化学方程式 。
(2)200℃时反应③的平衡常数表达式K= 。
(3)在一常温恒容的密闭容器中,放入一定量的甲醇如④式建立平衡,以下可以作为该反应达到平衡状态的判断依据为_______。
A.容器内气体密度保持不变 B.气体的平均相对分子质量保持不变
C.CO的体积分数保持不变 D.CO与H2的物质的量之比保持1:2不变
(4)工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,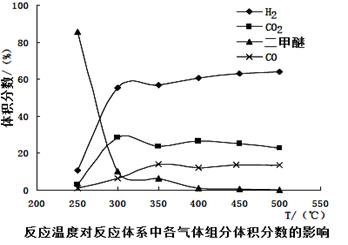

①你认为反应控制的最佳温度应为___________。
A.300~350℃ B.350~400℃
C.400~450℃ D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是__________(用相应的化学方程式表示)。
(5)某一体积固定的密闭容器中进行反应②,200℃时达平衡。请在下图补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,CO2的百分含量随时间变化图像。
(6)一定条件下,如图示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为 。
环境保护是现代的世界性课题,人类已在多方面取得了突破性进展。
(1)连续自动监测氮氧化物(NOx)的仪器——动态库仑仪已获得实际应用。它的工作原理如下图所示。NiO电极上NO发生的电极反应式为 。
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术。压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,相关反应为:
①CH4(g)+4NO2(g)  4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g)+4NO(g)  2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0
③CH4(g) +2NO2(g)  N2(g) +CO2(g) +2H2O(g) △H3
N2(g) +CO2(g) +2H2O(g) △H3
则△H3= (用△H1和△H2表示)。
(3)实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应③,测得在不同温度、不同投料比时,NO2的平衡转化率如下表:
| 投料比[n(NO2) / n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①在NO2与CH4反应时,可提高NO2转化率的措施有 (填编号)。
A.增加催化剂的表面积
B.改用高效催化剂
C.降低温度
D.增大压强
E.分离出H2O(g)
F.减小[n(NO2)/n(CH4)]
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,充入容 积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数。(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出0min~15min内,容器中CO2物质的量浓度c随时间变化的曲线图。
(4)SNCR是一种新型的烟气脱氮环保技术。在有氧条件下,其脱氮原理是:
NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) △H= -1627.2kJ·mol-1
4N2(g)+6H2O(g) △H= -1627.2kJ·mol-1
NO和NH3在Ag2O催化剂表面的反应随温度的变化曲线如右图所示。图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是(回答两条): 。
(1)人们常用催化剂来选择反应进行的方向。右图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
①写出1 moL HCHO生成CO的热化学方程式: 。
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是 。
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10 L定容容器中发生反应
2N2H4(g)+2NO2(g) 3N2(g)+4H2O(l) ΔH<0
3N2(g)+4H2O(l) ΔH<0
下列能说明反应达到平衡状态的是 。
a.混合气体密度保持不变 b.3v正(NO2)=2v逆(N2)
c.N2H4与NO2体积比保持不变 d.体系压强保持不变
②在某温度下,5L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/mol 时间 |
n (N2H4) |
n (NO2) |
n (N2) |
| 起始 |
2.0 |
3.0 |
0 |
| 第2min |
1.5 |
a |
0.75 |
| 第4min |
1.2 |
b |
1.2 |
| 第6min |
1.0 |
c |
1.5 |
| 第7min |
1.0 |
c |
1.5 |
请画出该反应中n(NO2)随时间变化曲线,并画出在第7min分别升温、加压、加催化剂的情况下n(NO2)随时间变化示意图。计算该温度下反应的平衡常数K(保留2位有效数字,写出计算过程)。
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O Cu2O+H2↑,如图所示。该电解池的阳极反应式为 。
Cu2O+H2↑,如图所示。该电解池的阳极反应式为 。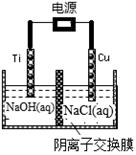
某温度时,在4L的容器中,X、Y、Z三种物质的量随时间的变化曲线如下图所示。
(1)由图中数据分析,该反应的化学方程式为:
(2)反应从开始至2min内X的平均反应速率是:
(3)反应过程中Y的转化率:
(4)2min后图像所表示的含义
(共16分)Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:

①燃料电池即电源的N极的电极反应式为 _______________________ ;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)  N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂
C.减小CO2的量 D.扩大容器体积
近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。

则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1) 处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ·mol-1
CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ·mol-1
CH4(g) + 2NO2 (g) = N2(g) + CO2(g) + 2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=______(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。

①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=_________________。
(15分)乙苯催化脱氢制苯乙烯反应:
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________(用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。
②控制反应温度为600℃的理由是____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加
和
,即可得到
,该反应的还原产物为。
(2)上述浓缩液中含有
、
等离子,取一定量的浓缩液,向其中滴加
溶液,当
开始沉淀时,溶液中
为:,已知
=1.8×10-10,
=8.5×10-17。
(3)已知反应
的
,1
、1
分子中化学键断裂时分别需要吸收436
、151
的能量,则1
分子中化学键断裂时需吸收的能量为
。
(4)
研究了下列反应:

在716
时,气体混合物中碘化氢的物质的量分数
与反应时间
的关系如下表:
| 0 |
20 |
40 |
60 |
80 |
120 |
|
| 1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
|
| 0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:。
②上述反应中,正反应速率为
正=
正·
,逆反应速率为
逆=
逆·
,其中
正、
逆为速率常数,则
逆为(以
和
正表示)。若
正 = 0.0027
,在
=40
时,
正=
③由上述实验数据计算得到
正~
和
逆~
的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母)

氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
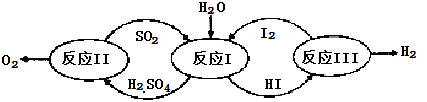
(1)反应Ⅰ的化学方程式是。
(2)反应Ⅰ得到的产物用进行分离。该产物的溶液在过量
的存在下会分成两层--含低浓度
的
层和高浓度的
的
层。
①根据上述事实,下列说法正确的是(选填序号)。
a.两层溶液的密度存在差异
b.加前,
溶液和HI溶液不互溶
c.在
溶液中比在
溶液中易溶
②辨别两层溶液的方法是。
③经检测,层中
=2.06:1。其比值大于2的原因是。
(3)反应Ⅱ:
它由两步反应组成:i.
ii.分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中的平衡转化率随X的变化关系。
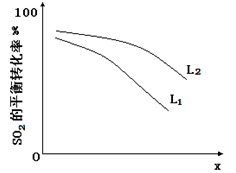
①X代表的物理量是。
②判断L1、L2的大小关系,并简述理由:。
(14分)苯乙烯(C6H5CH=CH2)是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等。工业上以乙苯(C6H5CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:
C6H5CH2CH3(g)  C6H5CH=CH2(g)+H2(g)
C6H5CH=CH2(g)+H2(g)  H
H
(1)已知:H2和CO的燃烧热( H)分别为-285.8 kJ.mol
H)分别为-285.8 kJ.mol 和-283.0 kJ.mol
和-283.0 kJ.mol ;
;
C6H5CH2CH3(g)+CO2 (g) C6H5CH=CH2(g)+CO(g)+H2O(l)
C6H5CH=CH2(g)+CO(g)+H2O(l)  H=+114.8 kJ·mol-1
H=+114.8 kJ·mol-1
则制取苯乙烯反应的 H为_________
H为_________
(2)向密闭容器中加入1 mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ。下列说法正确的是 _________。
| A.升高温度,正反应速率减小,逆反应速率增大 |
| B.若继续加入1 mol乙苯,苯乙烯转化率增大 |
| C.压缩体积,平衡逆向移动,反应物浓度增大,生成物浓度减小 |
| D.相同条件下若起始加入1 mol苯乙烯和1 mol氢气, |
达平衡时反应能量变化为( H-Q)kJ
H-Q)kJ
(3)向2 L密闭容器中加入1 mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。700 时,乙苯的平衡转化率为_______,此温度下该反应的平衡常数为 ______;温度高于970
时,乙苯的平衡转化率为_______,此温度下该反应的平衡常数为 ______;温度高于970 时,苯乙烯的产率不再增加,其原因可能是_________。
时,苯乙烯的产率不再增加,其原因可能是_________。
(4)含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2,该阳极的电极反应式为_________,若去除0.5 mol苯乙烯,两极共收集气体_________mol。
(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气.其中生成NO的能量变化示意图如右图:
①该反应的热化学方程式为 .
②根据下图所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K .
| A.可能增大 |
| B.一定不变 |
| C.可能不变 |
| D.可能减小 |
E.增大、减小、不变均有可能
(2)尿素(又称碳酰胺)是含氮量最高的氮肥,工业上利用CO2和NH3在一定条件下合成尿素的反应分为:
第一步:2NH3(g)+CO2(g) H2NCOONH4(氨基甲酸铵) (l)
H2NCOONH4(氨基甲酸铵) (l)
第二步:H2NCOONH4(l) H2O(g)+H2NCONH2(l)
H2O(g)+H2NCONH2(l)
某实验小组模拟工业上合成尿素的条件,在一体积为500 L的密闭容器中投入4 mol氨和1 mol二氧化碳,验测得反应中各组分的物质的量随时间的变化如图所示:
①合成尿素总反应的快慢由第 步反应决定.
②反应进行到10 min时测得 CO2 的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min).
③由氨基甲酸铵和CO2曲线变化可得出关于浓度变化和平衡状态的两条结论是:
a. ;
b. .
二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。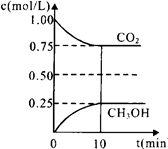
①能说明该反应已达平衡状态的是______ __。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化。
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O。 D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
②下列措施中能使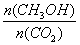 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g) C.将H2O(g)从体系中分离
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=__________。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如下图1所示。
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用上图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为________________________。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下: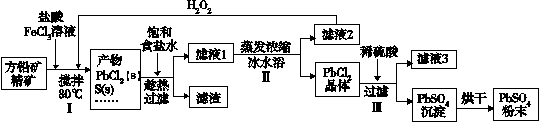
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(ⅱ)有关物质的Ksp和沉淀时的pH如下:
| Ksp |
|
开始沉淀时pH |
完全沉淀时pH |
|
| PbSO4 |
1.08×10-8 |
Fe (OH)3 |
2.7 |
3.7 |
| PbCl2 |
1.6×10-5 |
Pb(OH)2 |
6 |
7.04 |
(1)步骤Ⅰ中生成PbCl2的离子方程式_______,加入盐酸控制pH值小于2,原因是_______。
(2)用化学平衡移动原理解释步骤Ⅱ中使用冰水浴的原因______。若原料中FeCl3过量,则步骤Ⅱ得到的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_______。
(3)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式______。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因______。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为_______。
(6)双隔膜电解池的结构示意简图如图所示,利用铅蓄电池电解硫酸钠溶液可以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是____。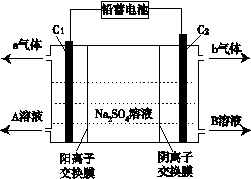
A.A溶液为氢氧化钠,B溶液为硫酸
B.C1极与铅蓄电池的PbO2电极相接、C2极与铅蓄电池的Pb电极相接
C.当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重49g
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
(7分) 固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。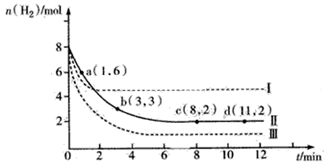
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡时CO2的转化率 。
(4)在恒温恒容的条件下,下列能说明该反应已经达到平衡状态的是_______。
A.K不变 B.容器内压强保持不变
C.v正(H2)=3v正(CO2) D.容器内的密度保持不变
(5)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅲ对应的实验条件改变是 。
A.升高温度
B.增大压强
C.加入的催化剂
D.降低温度
E.减小压强
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g) 2NH3(g),ΔH<0
2NH3(g),ΔH<0
①该反应的平衡常数K的表达式为:K=___________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式 。