工业废水中常含有一定量的和
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
其中第①步存在平衡:
(1)若平衡体系的,则溶液显色.
(2)能说明第①步反应达平衡状态的是。
a.和
的浓度相同
b.
c.溶液的颜色不变
(3)第②步中,还原1mol离子,需要mol的
。
(4)第③步生成的在溶液中存在以下沉淀溶解平衡:
常温下,的溶度积
,要使
降至
,溶液的
应调至。
方法2:电解法
该法用做电极电解含
的酸性废水,随着电解进行,在阴极附近溶液
升高,产生
沉淀。
(5)用做电极的原因为。
(6)在阴极附近溶液升高的原因是(用电极反应解释)。
溶液中同时生成的沉淀还有。
在一容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应: 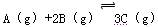 ,达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
,达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
请回答下列问题,
(1)该反应的平衡常数K随温度升高而 (填“增大”、“减少”或“不变”),该反应的焓变△H 0(填“>”、“<”或“=”)。
(2)30℃时,平衡混合气中C的体积分数ω= ,A物质的转化率与B物质的转化率之比为 。
(3)30℃时,若在同一容器中加入3 molA、4 molB和 molC,则平衡混合气中C的体积分数仍为ω,此时平衡时体系中A的物质的量浓度为 mol·L-1。
一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g)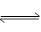 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)该反应的平衡常数表达式K= ;根据下图,升高温度,K值将 增大压强K值将 (填“增大”、“减小”或“不变”)。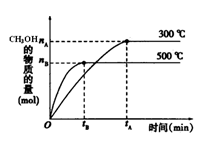
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 (用nA 、nB、 tA 、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a. v生成(CH3OH)= v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d. CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a. c(H2)减少 b正反应速率加快,逆反应速率减慢
c. CH3OH 的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)下图是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式: 。
(2)在固定体积的密闭容器中,进行如下化学反应: N2(g) +3H2(g) 2NH3(g);
2NH3(g);
①下列各项能说明该反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(H2)(逆) =)3v(N2)(正)
c.容器内压强保持不变 d.混合气体的密度保持不变
②若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比为1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度 (填增大、不变或减小,下同),NH3的体积分数 。
(3)科学家一直致力研究常温、常压下“人工固氮”的新方法。请回答下列问题:
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g);△H<0。
2NH3(g);△H<0。
①下图表示随条件改变,平衡混合气体中氨气的百分含
量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号,下同)_____________;当横坐标为温度时,变化趋势正确的是_________________。
②液氨与水相似,存在着微弱的电离,写出液氨发生电离的方程式: ___________________________
1 000 ℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应达到平衡:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g);ΔH>0
Na2S(s)+4H2O(g);ΔH>0
若反应在恒温恒容状态下进行,回答以下问题:
(1)向容器中分别加入以下物质,判断对平衡有无影响,有影响的应填写出平衡移动的方向。
①加入
Na2SO4___________________________________________________________________。
②加入焦炭
_____________________________________________________________________。
(2)若将容器温度升高20 ℃,H2在混合气体中的含量变化用下图中______图表示最合适。