钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
① 一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L,b mol/L,则SO2 起始物质的量浓度为_________mol/L;生成SO3的化学反应速率为__________mol/(L • min)。
②工业制硫酸,尾气SO2用__________吸收。
(2)全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:

①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
③放电过程中氢离子的作用是 和 ;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为 。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g) + NaCl(s) NaNO3(s) + ClNO(g) K1 ∆H < 0 (I)
NaNO3(s) + ClNO(g) K1 ∆H < 0 (I)
2NO(g) + Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g) + 2NaCl(s)  2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”、“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2 + 2NaOH ="=" NaNO3 + NaNO2 + H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol·L‾1的CH3COONa溶液,则两溶液中c(NO3—)、c(NO2—)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10—4mol·L‾1,CH3COOH的电离常数K a=1.7×10—5mol·L‾1),可使溶液A和溶液B的pH相等的方法是 (选填序号)。
| A.向溶液A中加适量水 | B.向溶液A中加适量NaOH |
| C.向溶液B中加适量水 | D.向溶液B中加适量NaOH |
减少二氧化碳的排放以及资源化利用具有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0 kJ·mol一1,
C(s) +2H2O(g) = CO2(g) + 2H2(g) △H="+113.4" kJ·mol一1;
则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
(2)目前 (NH4)2CO3已经被用作工业捕碳剂,为研究温度对(NH4)2CO3捕获CO2效率的影响,在T1温度下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图2)。则:
①该反应的ΔH 0(填“>”、“=”或“<”)。
②在T1~T2及T4~T5两个温度区间,容器内CO2气体浓度呈现如图2所示的变化趋势,其原因是 。
③该反应在温度为T1时,溶液pH随时间变化的趋势曲线如图1所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化总趋势曲线。

(3)利用该反应捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出两条)。
硫的化合物在科研、生活及化学工业中具有重要的应用。
(1)在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25℃,在0.10 mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
| pH |
3 |
5 |
7 |
9 |
11 |
| c(S2-)/ mol•L-1 |
1.4×10-15 |
1.4×10-11 |
6.8×10-8 |
1.3×10-5 |
1.3×10-3 |
某溶液含0.020 mol•L-1Mn2+、0.1 mol•L-1H2S,当溶液的pH=5时,Mn2+开始沉淀,则MnS的溶度积=________________。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g) 2H2(g)+S2(g) △H1,在膜反应器中分离出H2。
2H2(g)+S2(g) △H1,在膜反应器中分离出H2。
①已知:H2S(g) H2(g)+S(g) △H2,2S(g)
H2(g)+S(g) △H2,2S(g) S2(g)△H3。则△H1=_______(用含△H2、△H3的式子表示。
S2(g)△H3。则△H1=_______(用含△H2、△H3的式子表示。
②在密闭容器中,充入0.10molH2S(g),发生反应2H2S(g) 2H2(g)+S2(g),控制不同的温度和压强进行实验。结果如图所示。
2H2(g)+S2(g),控制不同的温度和压强进行实验。结果如图所示。
图中压强p1、p2、p3由大到小的顺序为_______________,理由是_________________。若容器的容积为2.0L,则压强为p3,温度为950℃时,反应经3h达到平衡,则达到平衡时v(S2)=__________;若压强p2=7.2MPa,温度为975℃时,该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),若保持压强不变,升温到1000℃时,则该反应的平衡常数___________(填“增大”“不变”或“减小”)。
(3)工业上用惰性电极电解KHSO4饱和溶液制取H2O2,示意图如图所示:
①低温电解饱和KHSO4溶液时阳极的电极反应式为_________________。
②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式为_________________。
(15分)最近科学家提出“绿色自由”构想:把含有大量CO2的空气吹入碳酸钾溶液中,再把CO2从溶液中提取出来,并使之与氢气反应生成可再生能源甲醇。其工艺流程如图所示: 
(1)写出分解池中反应的化学方程式为_______________;
(2)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出4947kJ的热量,试写出该反应的热化学方程式_______________;
(3)已知合成塔中的反应是可逆的,根据平衡移动原理,低温有利于原料气的转化,而实际生产中采用300℃的温度,其原因可能是_______________;
(4)“绿色自由”构想流程中常包括物质的“循环利用”,上述流程中能体现“循环利用”的物质除碳酸钾溶液外,还包括________(化学式)。
(5)300℃时,将CO和H2按1:3的体积比充入密闭容器中,CO2的平衡转化率(α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再达平衡是,与原平衡比较下列说法正确的是________。
| A.CO2的浓度减小 |
| B.正反应速率增大,逆反应速率减小 |
| C.CO2和H2的体积比为1:3 |
| D.CH3OH的体积分数增大 |
②将1.0molCO2和3.0molH2置于体积不变的密闭容器中,2min时反应达到平衡,此时体系总压强为0.10MPa,用H2表示的反应速率为1.2mol/(L·min),则密闭容器的体积是____L。
(6)甲醇可制作燃料电池。以氢氧化钾溶液为电解质的负极反应式是__________。当转移的电子的物质的量为_______mol时,参加反应的氧气的体积是6.72L(标准状况下)。
硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g) 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度 |
450 |
500 |
550 |
600 |
| SO2的转化率% |
97.5 |
95.8 |
90.50 |
80.0 |
(1)由表中数据判断△H 0(填“>”、“=”或“<”)
(2)能判断该反应是否达到平衡状态的是
A 容器的压强不变 B 混合气体的密度不变
C 混合气体中SO3的浓度不变 D C(SO2)=C(SO3)
E V正(SO2)=V正(SO3) F V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1.
①0~2min之间,O2的反应速率为 .
②此时的温度为 ℃.
③此温度下的平衡常数为 (可用分数表示).
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将 向移动.
减少污染、保护环境是全世界最热门的课题。
I.CO在催化剂作用下可以与H2反应生成甲醇:
①CO(g)+2H2(g)  CH3OH(g),△H1
CH3OH(g),△H1
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 |
H-H |
C-O |
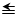 C O C O |
H-O |
C-H |
| E/(kJ·mol-1) |
436 |
343 |
876 |
465 |
413 |
由此计算△H1= 。
(2)图1中能正确反映反应①平衡常数的对数lgK随反应温度T的变化曲线为 (填曲线标记字母),其判断理由是 。

(3)在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图2。
①P1 P2(填“大于”或“小于”),其判断理由是 。
②M、N、Q三点平均速率ν(M)、ν(N)、ν(Q)大小关系为 。
③M、N、Q三点平衡常数KM、KN、KQ大小关系为 。
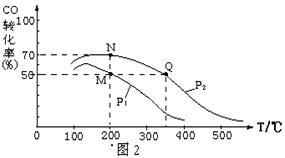
II.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示。已知:气体分压(P分)= 气体总压(P总)× 体积分数。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示。已知:气体分压(P分)= 气体总压(P总)× 体积分数。
完成下列填空:
①650℃时,反应达平衡后CO2的转化率为 。
②T℃时,若充入等体积的CO2和CO,平衡 (填“向左移动”、“向右移动”或“不移动”)
③925℃时,P总=1/96MPa,用平衡分压代替平衡浓度表示的化学平衡常数KP= 。
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:

(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:

由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为 ;
②乙苯的平衡转化率为 ;
③计算此温度下该反应的平衡常数 。
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(3)已知:

计算上述反应的ΔH= kJ/mol。
当前我国环境状况不容乐观,其中PM2.5、CO、S02、NOx等污染物对空气质量的影响非常显著,其主要来源为燃煤、机动车尾气等,因此,对其进行研究具有重要意义。
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样中的化学组分及其平均浓度如下表:

根据表中数据计算该试样的pH=
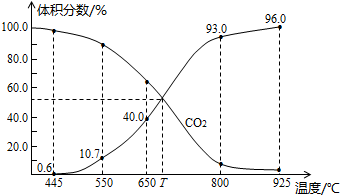
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图1所示。
①写出N2和02反应的热化学方程式:________。
②有人设想将C0按下列反应除去:2CO(g)= 2C(s)+02(g)△H>O,请你分析该设想能否实现? (填“是”或“否”),依据是
③用图2所示原电池原理也可以除去CO,则其负极反应式为:________。
(3)有人设想利用反应NaOH+S02=NaHS03将SO2吸收除去,然后用石灰水又可使NaOH再生。再生的离子方程式为: 。
(4)利用I205消除CO污染的反应为:5CO(g)+I205(s)—兰5CO2(g)+I2(s),不同温度下,测得CO2的体积分数随时间t变化曲线如图3.则:
①该反应的化学平衡常数表达式为K=____ 。
②T1与T2化学平衡常数大小关系:K(T1)__________K(T2)(填“>”、“<”或“=”)
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。工业制硫酸的过程中,SO2催化氧化的原理:
2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
(1)某温度下,测得SO2(g)的平衡转化率(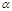 )与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“=”,下同)SO3浓度c(a) c(b)c点,反应速率υ(正) υ(逆)。
)与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“=”,下同)SO3浓度c(a) c(b)c点,反应速率υ(正) υ(逆)。
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
||
| SO2 |
O2 |
SO2 |
O2 |
||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) CH3OCH3(g) + CO2(g)的ΔH= ;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(g) + CO2(g)的ΔH= ;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:

① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 温度升高,该反应的平衡常数K (填“增大”、“减小”或“不变”)
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应。常用来生产液氨和氨水。
完成下列填空:
(1)右图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ。请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)。

该图中的实线与虚线部分是什么反应条件发生了变化? 。
(2)在一定温度下,若将4amol H2和2amol N2放入VL的定容密闭容器中,2分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为 摩尔/(升–秒)。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (填“正向移动”“逆向移动”或“不移动”)。
(3)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K 2×10-30(填“<”、“>”或“=”);
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K 2×10-30(填“<”、“>”或“=”);
②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒物质的量大小排列为:
(4)工厂生产的氨水作肥料时需要稀释。用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是 。
a.c(NH4+)/c(NH3•H2O) b.c(NH3•H2O)/c(OH-)
c.c(OH-)/c(H+) d.c(H+)/c(NH4+)
碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应如下:Fe2O3(s) + 3CH4(g)  2Fe(s) + 3CO(g) +6H2(g) ΔH>0
2Fe(s) + 3CO(g) +6H2(g) ΔH>0
① 若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为 _________ 。
② 若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是_____(选填序号)
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③ 该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA____KB(填“>”、“ <”或“=”)。纵坐标可以表示的物理量有哪些 。

a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2  N2O4;△H<0)
N2O4;△H<0)

(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_______VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将___________(填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_____,B中NO2的转化率将_______(填: 变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,___________中的颜色较深。
二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g)+CO(g)  CH3OH(g) ΔH=" —90.0" kJ·mol-1 ①
CH3OH(g) ΔH=" —90.0" kJ·mol-1 ①
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=" —24.5" kJ·mol-1 ②
CH3OCH3(g)+H2O(g) ΔH=" —24.5" kJ·mol-1 ②
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=" —41.1" kJ·mol-1 ③
CO2(g)+H2(g) ΔH=" —41.1" kJ·mol-1 ③
(1)反应①的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下该反应自发进行。
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是 (填选项字母)。
| A.容器内气体密度保持不变 | B.CO与CO2的物质的量之比保持不变 |
| C.H2O与CO2的生成速率之比为1∶1 | D.该反应的平衡常数保持不变 |
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率的影响如图1所示。图1中A点的v(逆) B点的v(正)(填“>”、“<”或“=”),说明理由 。实际工业生产中该合成反应的条件为500℃、4MPa请回答采用500℃的可能原因 。


(4)一定温度下,密闭容器中发生反应③,水蒸气的转化率与n(H2O)∕n(CO)的关系如图:计算该温度下反应③的平衡常数K= 。在图2中作出一氧化碳的转化率与n(H2O)∕n(CO)的曲线。