二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g)+CO(g)  CH3OH(g) ΔH=" —90.0" kJ·mol-1 ①
CH3OH(g) ΔH=" —90.0" kJ·mol-1 ①
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=" —24.5" kJ·mol-1 ②
CH3OCH3(g)+H2O(g) ΔH=" —24.5" kJ·mol-1 ②
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=" —41.1" kJ·mol-1 ③
CO2(g)+H2(g) ΔH=" —41.1" kJ·mol-1 ③
(1)反应①的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下该反应自发进行。
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是 (填选项字母)。
| A.容器内气体密度保持不变 | B.CO与CO2的物质的量之比保持不变 |
| C.H2O与CO2的生成速率之比为1∶1 | D.该反应的平衡常数保持不变 |
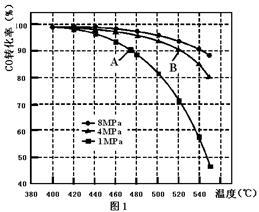
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率的影响如图1所示。图1中A点的v(逆) B点的v(正)(填“>”、“<”或“=”),说明理由 。实际工业生产中该合成反应的条件为500℃、4MPa请回答采用500℃的可能原因 。
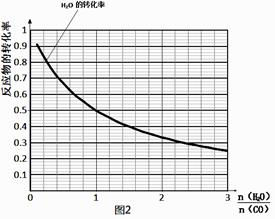
(4)一定温度下,密闭容器中发生反应③,水蒸气的转化率与n(H2O)∕n(CO)的关系如图:计算该温度下反应③的平衡常数K= 。在图2中作出一氧化碳的转化率与n(H2O)∕n(CO)的曲线。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号