(5分) 25℃时,若体积为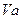 、
、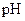 =" a" 的某一元强酸与体积为
=" a" 的某一元强酸与体积为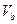 、
、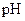 =" b" 的某一元强碱混合,恰好中和,且已知
=" b" 的某一元强碱混合,恰好中和,且已知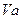 <
<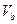 和 a = 0.5b。则:
和 a = 0.5b。则:
(1)a值可否等于3 (填“可”或“否”) ,其理由是  。
。
(2)a值可否等于5(填“可”或“否”) ,其理由是 。
(3)a 的取值范围__________________________________________________。
(5分) 25℃时,若体积为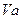 、
、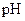 =" a" 的某一元强酸与体积为
=" a" 的某一元强酸与体积为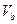 、
、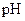 =" b" 的某一元强碱混合,恰好中和,且已知
=" b" 的某一元强碱混合,恰好中和,且已知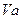 <
<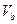 和 a = 0.5b。则:
和 a = 0.5b。则:
(1)a值可否等于3 (填“可”或“否”) ,其理由是  。
。
(2)a值可否等于5(填“可”或“否”) ,其理由是 。
(3)a 的取值范围__________________________________________________。