将煤气化后液化所得的重要产品之一是甲醇。其制备反应:CO(g) +2H2(g) 
CH3OH(g);△H<0。为了增加甲醇的产量,同时保证较高的生产效率。工厂应采取的正确措施是
| A.高温、高压 | B.适宜温度、高压、催化剂 |
| C.低温、低压、不断分离出甲醇 | D.低温、高压、催化剂 |
反应:①PCl5(g) PCl3(g)+Cl2(g) ②2HI(g)
PCl3(g)+Cl2(g) ②2HI(g) H2(g)+I2(g) ③2NO2(g)
H2(g)+I2(g) ③2NO2(g) N2O4(g)
N2O4(g)
在一定条件下,达到化学平衡时,反应物的转化率均是 a%。若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率
| A.均不变 | B.①增大,②不变,③减少 |
| C.均增大 | D.①减少,②不变,③增大 |
t℃时,在两个相同的密闭刚性容器(等容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g) 2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
数据分析发现:达到平衡时,化学状态Ⅰ和化学状态Ⅱ完全相同。下列叙述不正确的是
| A.若实验ⅠSO2的起始浓度为1mol/L,则实验ⅠO2的起始浓度为0.5mol/L;实验ⅡSO3的起始浓度为1mol/L. |
| B.若实验ⅠSO2的转化率为a%,则实验ⅡSO3 的转化率为1-a%。 |
| C.若起始浓度C(SO2) m mol/L,C(O2)=" n" mol/L,C(SO3)=" p" mol/L,在相同条件下进行实验,要求达到平衡时的状态与实验Ⅰ、Ⅱ完全相同,则m、n、p必须满足的条件是m/n="2" 和 m+p=1。 |
| D.维持实验Ⅰ的起始浓度和实验温度不变,改密闭刚性容器为密闭可变体积容器(等压容器)进行实验,达到化学平衡时:SO2的转化率与实验Ⅰ中SO2的转化率相比要小,但正反应速率与实验Ⅱ相比要大。 |
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
| A.a=3 | B.a=2 | C.B的转化率为40% | D.B的转化率为60% |
下列说法正确的是( )
| A.一定温度下,反应MgCl2(l)===Mg(l)+Cl2(g)的ΔH>0、ΔS<0 |
B.水解反应NH+H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.对于反应2H2O2===2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率 |
下列事实可以用勒夏特列原理解释的是( )
| A.新制的氯水在光照条件下颜色变浅 |
| B.使用催化剂,提高合成氨的产率 |
| C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D.H2、I2、HI平衡混合气体加压后颜色变深 |
下列说法正确的是
| A.饱和氯水中加水稀释,促进氯水中水的电离 |
| B.向氨水中加入氯化铵,由于氯化铵溶液呈酸性,所以溶液pH降低 |
C.碳酸钠溶液中存在CO32-+H2O  HCO3-+OH-平衡,若通入CO2,则平衡逆向移动 HCO3-+OH-平衡,若通入CO2,则平衡逆向移动 |
| D.向氢氧化镁悬浊液中加水稀释,Mg(OH)2沉淀溶解平衡正向移动,但c(Mg2+)降低 |
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示可得出的判断结论正确的是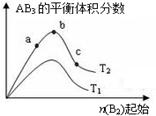
| A.达到平衡时,AB3的物质的量大小为:c>b>a |
| B.达到平衡时,A2的转化率大小为:b>a>c |
| C.若T2>T1,则正反应一定是放热反应 |
| D.a点的化学平衡常数小于c点的化学平衡常数 |
将0.l mol·L-1醋酸溶液加水稀释,下列说法正确的是
| A.溶液中c(H+)和c(OH-)都减小 | B.溶液中c(H+)增大 |
| C.醋酸电离平衡向左移动 | D.溶液的pH增大 |
在体积相同的A、B两个带活塞的玻璃容器中,分别注入1/4体积颜色相同的NO2与溴蒸气,然后将活塞同时向外拉出到1/2(快速),过一会可以看到
A、A中的颜色比B中的浅 B、A中的颜色比B中的深
C、A中的颜色与B中的深浅相同 D、A中颜色比开始时深
可以充分说明反应 在恒温下已达到平衡的是
在恒温下已达到平衡的是
| A.反应容器内的压强不随时间改变 |
| B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 |
| D.反应容器内的气体总物质的量不随时间变化 |
在容积一定的密闭容器中发生可逆反应 ,
, ;平衡移动关系如图所示。下列说法正确的是
;平衡移动关系如图所示。下列说法正确的是
| A.P1< P2,纵坐标指A的质量分数 |
| B.P1> P2,纵坐标指C的质量分数 |
| C.P1< P2,纵坐标指A的转化率 |
| D.P1< P2,纵坐标指混合气体的平均摩尔质量 |
下列事实,不能用勒夏特列原理解释的是( )
| A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率 |
B.对2HI H2+I2平衡体系增加压强使颜色变深 H2+I2平衡体系增加压强使颜色变深 |
| C.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| D.滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深 |
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应
A(s)+2B(g) C(g)+D(g)已达平衡状态的是( )
C(g)+D(g)已达平衡状态的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的平均相对分子质量 |