[山东]2013届山东省聊城市某重点高中高三上学期1月份模块检测化学试卷
正确掌握化学用语和化学基本概念是学好化学的基础。下列各项中表达正确的是
A.NaCl的电子式: |
B.H2O分子的分子结构模型示意图: (三个原子在同一直线上) (三个原子在同一直线上) |
C.CrO5的结构式为 ,该氧化物中Cr为+6价 ,该氧化物中Cr为+6价 |
| D.次氯酸的结构式:H-Cl-O |
将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al3+、Mg2+、NH4+的物质的量分别是
| A.2mol、3mol、4mol | B.2mol、3mol、8mol |
| C.3mol、2mol、8mol | D.3mol、2mol、4mol |
在容积一定的密闭容器中发生可逆反应 ,
, ;平衡移动关系如图所示。下列说法正确的是
;平衡移动关系如图所示。下列说法正确的是
| A.P1< P2,纵坐标指A的质量分数 |
| B.P1> P2,纵坐标指C的质量分数 |
| C.P1< P2,纵坐标指A的转化率 |
| D.P1< P2,纵坐标指混合气体的平均摩尔质量 |
右图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3 Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
| A.当有0.01 mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112 mL |
B.负极反应为4Na 4e-=4Na+ 4e-=4Na+ |
| C.闭合K后,b电极附近的pH变小 |
| D.闭合K后,a电极上有产生氢气 |
NaCl是一种化工原料,可以制备一系列物质(如下右图所示)。下列说法正确的是
| A.石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
| B.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| C.常温下干燥Cl2能用钢瓶贮运,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |
下表给出几种氯化物的熔点和沸点(*表示在2.5×1.01×105 Pa下测定):
| |
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
| 熔点(℃) |
801 |
714 |
190* |
―68 |
| 沸点(℃) |
1465 |
1418 |
180 |
57 |
下列有关叙述,不正确的是
A.AlCl3在加热时升华
B.SiCl4晶体属于分子晶体
C.1500℃时NaCl存在气态分子
D.AlCl3晶体是典型的离子晶体
把乙烯和丙烯两种有机物按一定的比例混合,在一定条件下反应,所形成的高分子化合物结构简式可能为
①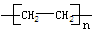
②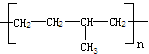
③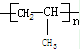
④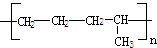
| A.①③ | B.①②③④ | C.①②③ | D.②④ |
a mol乙炔跟b mol氢气在密闭容器中反应,当其达到平衡时,生成c mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是
A.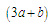 mol mol |
B.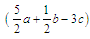 mol mol |
C.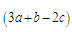 mol mol |
D.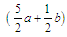 mol mol |
下列关于Na2O和 Na2O2叙述正确的是( )
| A.都为白色固体 |
| B.都能与CO2反应生成碳酸钠 |
| C.向Na2O和 Na2O2固体中分别加水再滴加2滴酚酞,最终溶液都为红色 |
| D.都为碱性氧化物,与水反应都能生成碱NaOH |
下列各组离子一定能大量共存的是( )
A.在无色溶液中: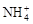 、Cu2+、 、Cu2+、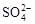 、 、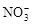 |
B.在含Fe3+的溶液中: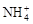 、Na+、Cl-、OH- 、Na+、Cl-、OH- |
C.在强碱溶液中:Na+、K+、Cl-、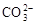 |
D.在强酸性的溶液中:K+、Na+、Cl-、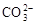 |
用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A.2 L 0.1 mol·L-1 K2SO4溶液中离子所带电荷总数约为0.6 NA |
| B.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的原子总数均为NA |
| C.1 mol Cl2变为Cl-时得到的电子数为NA |
| D.在常温常压下,18g水所含的电子数目为10NA |
能正确表示下列化学反应的离子方程式的是( )
A.碳酸钙和盐酸反应:CO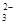 +2H+ +2H+ H2O+CO2↑ H2O+CO2↑ |
| B.铜片插入硝酸银溶液中:Cu + Ag+ =Cu2+ + Ag |
C.向稀硫酸溶液中加铁:3Fe+6H+ 3Fe3++3H2↑ 3Fe3++3H2↑ |
| D.氧化镁与稀硝酸混合: MgO+2H+=Mg2++H2O |
【下列化学反应的离子方程式正确的是( )
| A.在氢氧化钡溶液中滴加硫酸:Ba2++2OH- +2 H+ +SO42-="=" BaSO4↓ +2 H2O |
| B.氧化铁与稀硫酸反应:Fe2O3 + 6H+ = Fe2+ + 3H2O |
| C.少量金属钠放入冷水中:Na + 2H2O ="=" Na+ + 2OH- + H2↑ |
| D.将二氧化碳气体通入澄清石灰水中:2OH- + CO2 ="=" CO32- + H2O |
用如图所示的方法研究某气体的性质,这种方法属于( )
| A.实验法 | B.观察法 | C.分类法 | D.比较法 |
下列说法正确的是 ( )
| A.阿伏加德罗常数为6.02×1023 |
| B.摩尔质量等于该粒子的相对原子质量或相对分子质量 |
| C.1molH2的体积为22.4L |
| D.Na+的摩尔质量为23g/mol |
如图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )
| A.4>2>1>3 | B.2>1>3>4 |
| C.4>2>3>1 | D.3>2>4>1 |
如图所示是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数图象(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( )
| A.各电解池析出气体的体积 | B.各电解池阳极质量的增加量 |
| C.各电解池阴极质量的增加量 | D.各电极上放电的离子总数 |
将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如下图所示。最先观察到变为红色的区域为( )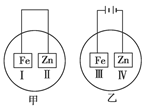
| A.Ⅰ和Ⅲ | B.Ⅰ和Ⅳ | C.Ⅱ和Ⅲ | D.Ⅱ和Ⅳ |
对于可逆反应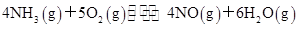 ,下列叙述正确的是
,下列叙述正确的是
| A.达到化学平衡状态时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到化学平衡状态 |
| C.达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率的关系为2v正(NH3)=3v正(H2O) |
可逆反应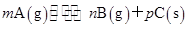
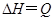 ,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )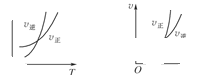
| A.m>n,Q>0 | B.m>n+p,Q>0 |
| C.m>n,Q<0 | D.m<n+p,Q<0 |
工业上用CO生产燃料甲醇。一定条件下发生反应: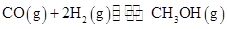 。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。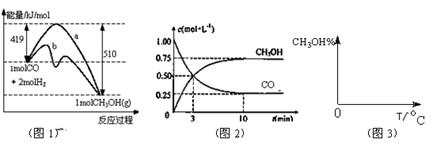
请回答下列问题:
(1)在“图1”中,曲线 (填a或b)表示使用了催化剂;该反应属于 (填吸热、放热)反应。
(2)下列说法正确的是
| A.起始充入的CO为1mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小 |
(3)从反应开始到建立平衡,v(H2)= ;该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ;ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
(8分)现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1 mol·L-1的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
⑴其中操作正确的同学是___ _____。
⑵证明有Fe(OH)3胶体生成利用的胶体性质是______ __。
⑶在胶体中加入电解质溶液或带有相反电荷的胶体微粒能使胶体微粒沉淀出来。丁同学利用所制得的Fe(OH)3胶体进行实验:
① 将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极区附近的颜色逐渐变深,这表明Fe(OH)3胶体微粒带__________(填“正”或“负”)电荷。
② 若向其中加入饱和Na2SO4溶液,产生的现象是 。
③若向其中加入浓盐酸溶液,产生的现象是 。
(4)Fe(OH)3胶体制备的化学方程式为 。
X、Y、Z、W为电子数相同的分子或离子。X有5个原子核。通常状况下,W为无色液体。它们之间转化关系如图所示,请回答: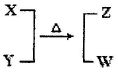
(1)工业上每制取1molZ要放出46.2 kJ的热量,写出该反应的热化学方程式: 。
(2)实验室制取Z的方法不止一种,写出其中一种方法的化学方程式: 。
(3)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。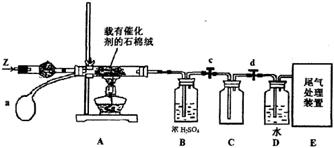
①A中发生反应的化学方程式是 。
②B中浓H2SO4的作用是 。
(4)写出D装置中反应的化学方程式 。
(5)向含有ag HNO3的稀溶液中,加入bg铁粉充分反应,铁粉全部溶解。已知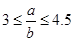 ,则被还原的HNO3的质量为 g。
,则被还原的HNO3的质量为 g。
Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出一点即可)。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
(1)甲装置常常浸在70~80℃的水浴中,目的是 。
(2)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接 、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在 _____ 中。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号