合成氨反应:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g);ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:

下列说法正确的是
| A.t1时升高了温度 | B.t2时使用了催化剂 |
| C.t3时增大了压强 | D.t4时降低了温度 |
在一容积可变的密闭容器中进行反应3Fe(s)+4H2O(g) 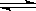 Fe3O4(g)+4H2(g),下列有关叙述正确的是
Fe3O4(g)+4H2(g),下列有关叙述正确的是
| A.增加Fe的量,正反应速率增大 |
| B.将容器的体积缩小一半,正逆反应速率增大 |
| C.保持体积不变,充入Ne,正逆反应速率增大 |
| D.保持压强不变,充入Ne,正逆反应速率不变 |
在体积不变的绝热密闭容器中,2molSO2与1molO2在催化剂作用下发生反应:2SO2(g)+ O2(g) 2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
| A.增大氧气浓度,平衡正向移动,平衡常数不变 |
| B.降低温度,正反应速率比逆反应速率减小的程度小 |
| C.平衡时SO2气体的转化率为50% |
| D.该条件下反应放出0.5QkJ的热量 |
在密闭容器中进行下列反应:M(g)+N(g) R(g)+2L,此反应符合下面图像,下列叙述正确的是
R(g)+2L,此反应符合下面图像,下列叙述正确的是

| A.正反应吸热,L是气体 |
| B.正反应吸热,L是固体 |
| C.正反应放热,L是气体 |
| D.正反应放热,L是固体或液体 |
下列说法不正确的是
甲 乙 丙 丁
A.绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)  2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 |
| B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。 |
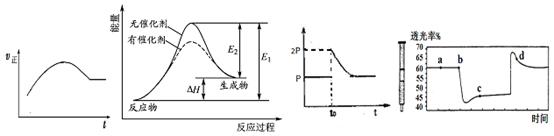
C.将BaO2放入密闭真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 |
D.将一定量的NO2充入针筒中后封口,发生反应2NO2 (g) N2O4(g),图丁表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)减小。 N2O4(g),图丁表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)减小。 |
如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态: 2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是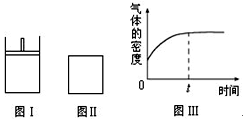
| A.物质Z的化学计量数a = 2 |
| B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ﹤Ⅱ |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr;△H﹤0,平衡时Br2(g)的转化率为a;若初使条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2HBr;△H﹤0,平衡时Br2(g)的转化率为a;若初使条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
| A.无法确定 | B.a=b | C.a﹤b | D.a﹥b |
在一定的温度下, 向一密闭容器中放入 1 mol A 和 1 mol B, 发生下列反应:A(g) + B(g)  C(g) + 2D(g),达到平衡状态时,C的含量为 m%,保持温度和体积不变,若按照下列配比在上述容器放入起始物质,达到平衡状态时C的含量仍然为m%的是
C(g) + 2D(g),达到平衡状态时,C的含量为 m%,保持温度和体积不变,若按照下列配比在上述容器放入起始物质,达到平衡状态时C的含量仍然为m%的是
| A.2mol A + 1mol B |
| B.1mol C + 1mol D |
| C.2mol C + 2mol D |
| D.0.5mol A +0.5mol B +0.5mol C +1mol D |
汽车尾气中NO产生的反应为:N2(g)+O2(g) 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
A.温度T下,该反应的平衡常数K=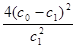 |
| B.温度T下,随着反应的进行,混合气体的密度减小 |
| C.曲线b对应的条件改变可能是加入了催化剂 |
| D.若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
现有下列三个图象:下列反应中符合下述全部图象的反应是
A.N2(g)+3H2(g) 2NH3(g) ΔH<0 2NH3(g) ΔH<0 |
B.2SO3(g) 2SO2(g)+O2(g) ΔH>0 2SO2(g)+O2(g) ΔH>0 |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
D.H2(g)+CO(g) C(s)+H2O(g) ΔH>0 C(s)+H2O(g) ΔH>0 |
一定温度下将0.2 mol气体A充入10 L恒容密闭容器中,进行反应:
2A(g)+B(g) 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
| t/min |
2 |
4 |
6 |
8 |
10 |
| n(A)/mol |
0.16 |
0.13 |
0.11 |
0.10 |
0.10 |
A.反应前2 min的平均速率ν(C) ="0.02" mol·L-1·min-1
B.平衡后降低温度,反应达到新平衡前ν(逆)> ν(正)
C.其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)⇌CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是
| A.温度: T1>T2>T3 |
| B.正反应速率:υ(b)>υ(d) υ(a)>υ(c) |
| C.平衡常数:K(a)>K(c) K(b)=K(d) |
| D.平均摩尔质量: M(b)>M(d) M(a)<M(c) |
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
| A.550℃时,若充入惰性气体,ʋ正,ʋ逆 均减小,平衡不移动 |
| B.650℃时,反应达平衡后CO2的转化率为25.0% |
| C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 |
| D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总 |