已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=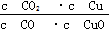 |
B.反应③的平衡常数K=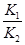 |
| C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的△H>0 |
| D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小 |
在恒压容器a和恒容容器b中,分别充入体积比为1∶3的N2和H2。若开始时两容器的体积相等,且在相同的条件下达到平衡时,两容器的N2的转化率应当是( )
| A.a中大 | B.b中大 | C.a、b一样大 | D.无法判断 |
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g),ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
nY(g),ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
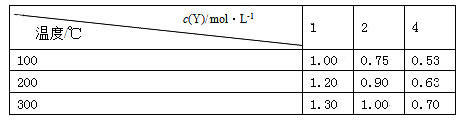
下列说法正确的是( )
| A.m>n |
| B.温度不变,压强增大,Y的质量分数减少 |
| C.Q<0 |
| D.体积不变,温度升高,平衡向逆反应方向移动 |
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s) Ag2O(s)+SO3(g)、2SO3(g)
Ag2O(s)+SO3(g)、2SO3(g) 2SO2(g)+O2(g) ,经10分钟反应达到平衡,此时c(SO3)="0.4" mol/L,c(O2)="0.05" mol/L,下列叙述不正确的是( )
2SO2(g)+O2(g) ,经10分钟反应达到平衡,此时c(SO3)="0.4" mol/L,c(O2)="0.05" mol/L,下列叙述不正确的是( )
| A.SO3的分解率为20% | B.10分钟内ν(SO2)=0.01mol/(L·min) |
| C.容器内气体的密度为40g/L | D.加压,容器内固体的质量不变 |
对于反应2NO2(g) N2O4(g)达到平衡后,在温度不变时欲使c(NO2)/c(N2O4)比值增大,可以采取( )
N2O4(g)达到平衡后,在温度不变时欲使c(NO2)/c(N2O4)比值增大,可以采取( )
| A.体积不变,增加NO2的量 | B.体积不变,增加N2O4的量 |
| C.使体积扩大到原来的2倍 | D.使体积不变充入N2 |
已知反应:CO(g) +3H2 (g)  .CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的是
.CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的是
| A.上述反应的△H<0 |
| B.N点时的反应速率一定比M点快 |
| C.降低温度,H2的转化率可达到100% |
| D.工业用此法制取甲烷应采用更高的压强 |
Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g) H="+11" kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g) H="+11" kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min |
0 |
20 |
40 |
60 |
80 |
120 |
| x(HI) |
1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
| x(HI) |
0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是
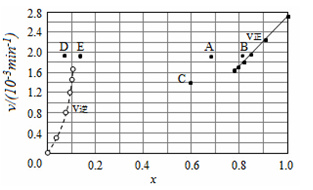
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
下列事实不能用平衡移动原理来解释的是( )
| A.打开啤酒瓶盖,产生大量气泡 |
| B.稀释CH3COOH时,溶液中CH3COO—数目增多 |
| C.工业合成氨常用500℃左右的温度 |
| D.热的纯碱溶液的去污效果比冷的好 |
某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
| |
初始 |
2 min |
4 min |
6 min |
| c (A)(mol/L) |
1.45 |
1.28 |
1.00 |
1.00 |
| c (B)(mol/L) |
0.38 |
0.72 |
1.28 |
1.28 |
| c (C)(mol/L) |
0.095 |
0.18 |
0.32 |
0.32 |
下列说法正确的是( )
A.该反应的化学方程式为A = 2B+C
B.4 min末A的转化率约为31%
C.4~6min时,反应停止了
D.正反应是吸热反应
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )

A.在t1min时,3V正(B)=2V逆(C)
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr;△H﹤0,平衡时Br2(g)的转化率为a;若初使条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2HBr;△H﹤0,平衡时Br2(g)的转化率为a;若初使条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
| A.无法确定 | B.a=b | C.a﹤b | D.a﹥b |
某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)  C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度 则能表明该反应一定已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度 则能表明该反应一定已达到平衡状态的是( )
| A.只有④ | B.②③ | C.②③④ | D.①③④ |
下列事实不能用勒夏特列原理来解释的是( )
| A.高压有利于氢气与氮气合成氨 |
| B.实验室中常用排饱和食盐水的方法收集Cl2 |
| C.用V2O5催化二氧化硫氧化为三氧化硫 |
| D.Cl2在水中的溶解度大于在饱和NaCl溶液中的溶解度 |