反应N2O4(g)  2NO2(g) 的正反应为吸热反应,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) 的正反应为吸热反应,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率:A > C
B.由状态B到状态A,可以用加热的方法
C.A、C两点混合气体的平均相对分子质量:A > C
D.B、C两点的反应速率相等
COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑤ | D.③⑤⑥ |
在一容积可变的密闭容器中,aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
| A.平衡向正反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减小了 | D.化学计量数关系a>b |
在体积固定的密闭容器中进行可逆反应:2NO2(g)  2NO(g)+O2(g),下列能作为反应达到平衡状态标志的是
2NO(g)+O2(g),下列能作为反应达到平衡状态标志的是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.②③⑤⑦ | B.①④⑥⑦ | C.①③④⑤ | D.全部 |
下列有关实验现象和解释或结论都正确的是
| 选项 |
实验操作 |
实验现象 |
解释或结论 |
| A |
将充满NO2的密闭玻璃球浸泡在热水中 |
红棕色变深 |
反应2NO2⇌N2O4的△H<0 |
| B |
将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 |
下层分别呈无色和紫红色 |
还原性:I->Br->Fe2+ |
| C |
某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 |
有白色沉淀出现 |
该钾盐是K2CO3 |
| D |
把SO2通入紫色石蕊试液中 |
紫色褪去 |
SO2具有漂白性 |
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)  2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是( )
| A.550℃时,若充入惰性气体,v正,v逆 均减小,平衡不移动 |
| B.650℃时,反应达平衡后CO2的转化率为25.0% |
| C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 |
| D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总 |
在体积均为1.0L的两个恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

A.反应CO2(g)+c(s) 2CO(g) △S>0、△H<0 2CO(g) △S>0、△H<0 |
| B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ) >2c(CO,状态Ⅲ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
| A.m=2 | B.两次平衡的平衡常数相同 |
| C.X与Y的平衡转化率之比为1:1 | D.第二次平衡时,Z的浓度为0.4 mol·L-1 |
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g) COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
| A.升高温度,H2S浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率逐渐增大 |
| C.反应前H2S物质的量为7mol |
| D.CO的平衡转化率为80% |
在一定温度下可逆反应N2+3H2 2NH3已达到平衡,下列有关说法正确的 ( )
2NH3已达到平衡,下列有关说法正确的 ( )
①1个N≡N键断裂的同时,有3个H—H键形成
②反应混合物中各组分的体积分数保持不变
③恒温恒容时,容器内的压强不再改变
④1个N≡N键断裂的同时,有3个N—H键形成
⑤NH3生成的速率与NH3分解的速率相等
⑥单位时间生成nmolN2,同时生成2nmolNH3
⑦气体的平均相对分子质量不再改变
⑧N2H2NH3的分子数一定为1∶3∶2
⑨恒温恒容时,气体的总物质的量不再改变
⑩恒温恒压时,容器内的密度不再改变
| A.①②③④⑤⑥⑦⑨ | B.①②③⑤⑥⑩ | C.③④⑤⑥⑦ ⑧ | D.①②③⑤⑥⑦⑨⑩ |
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g) COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
| A.升高温度,H2S浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率逐渐增大 |
| C.反应前H2S物质的量为7mol |
| D.CO的平衡转化率为80% |
对于合成氨反应,达到平衡后,以下分析正确的是( )
| A.升高温度,对正反应的反应速率影响更大 |
| B.增大压强,对正反应的反应速率影响更大 |
| C.减小反应物浓度,对逆反应的反应速率影响更大 |
| D.加入催化剂,对逆反应的反应速率影响更大 |
炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2 L的密闭容器中,高温下进行下列反应:C(s)+CO2(g) =2CO(g) ΔH=Q kJ·mol-1。下图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
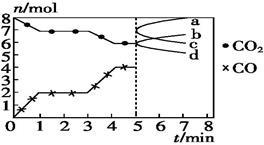
| A.0~1 min,v(CO)=1 mol·L-1·min-1;1~3 min,v(CO)=v(CO2) |
| B.当容器内的压强不变时,反应一定达到平衡状态,P(平衡) /P(起始) < 1 |
| C.3 min时,温度由T1升高到T2,则Q>0,再达平衡时,K(T2)/ K(T1)> 1 |
| D.5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化 |