在两个容积均为1 L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g) + 6H2 (g) C2H4(g) + 4H2O(g) ΔH。CO2的平衡转化率
C2H4(g) + 4H2O(g) ΔH。CO2的平衡转化率
α(CO2)与温度的关系如下图所示。
下列说法正确的是
| A.该反应的ΔH > 0 |
| B.氢碳比:X< 2.0 |
| C.在氢碳比为2.0时,Q点v(逆)小于P点的v(逆) |
| D.P点温度下,反应的平衡常数为512 |
一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H>0。现将1molA和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是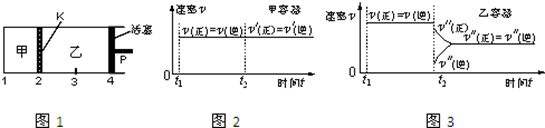
| A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 |
| C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
已知某可逆反应:2M(g) N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是
N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是
| A.a、b、c、d四个点中处于平衡状态的点是a、b |
| B.反应进行至25 min时,曲线发生变化的原因是加入了0.4 mol N |
| C.若调节温度使35 min时体系内N的体积分数与15 min时相等,应升高温度 |
| D.若在40 min时出现如图所示变化,则可能是因为加入催化剂引起的 |
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)  M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验 编号 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
|||
| n(X) |
n(Y) |
n(M) |
||||
| ① |
700 |
0.40 |
0.10 |
0.090 |
||
| ② |
800 |
0.10 |
0.40 |
0.080 |
||
| ③ |
800 |
0.20 |
0.30 |
a |
||
| ④ |
900 |
0.10 |
0.15 |
b |
||
下列说法正确的是
A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
在恒容条件下发生反应A(g)+3B(g) 2 C(g)(△H<0),改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如下图所示,下列说法中正确的是
2 C(g)(△H<0),改变其他反应条件,在Ⅰ、Ⅱ阶段体系中各物质浓度随时间变化的曲线如下图所示,下列说法中正确的是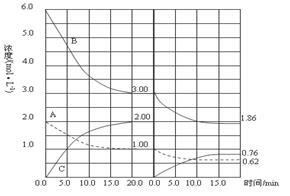
A.第Ⅰ阶段用C表示的平衡前的反应速率v (C)=0.1 mol/(L·s)
B.第Ⅱ阶段中B的平衡转化率αⅡ(B)为0.019
C.第Ⅰ阶段的平衡常数KⅠ与第Ⅱ阶段平衡常数KⅡ的大小关系是:KⅠ﹤KⅡ
D.由第一次平衡到第二次平衡,可能采取的措施是从反应体系中移出产物C
下列各表述与示意图一致的是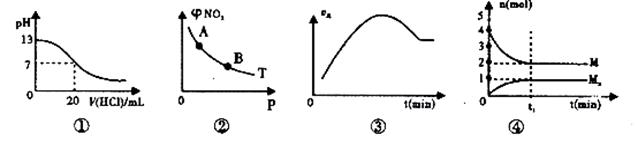
| A.图①表示室温时,用0.1 mol.L-1盐酸滴定0.1 mol·L-1NaOH溶液过程中的pH变化 |
B.T℃时,反应2NO2(g) N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 |
| C.图③表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应 2A2(g)+B2(g)  2C(g)达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 2C(g)达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 |
D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g) Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时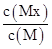 将增大 将增大 |
可逆反应2NO2 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO2
②单位时间内生成n molO2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
一定条件下,对于可逆反应N2(g)+3H2(g) 2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
| A.C1:C2=1:3 |
| B.平衡时,H2和NH3的生成速率之比为2:3 |
| C.N2、H2的转化率之比为1:3 |
| D.C1的取值范围为0.04 mol·L-1<C1<0.14 mol·L-1 |
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同.已知t3~t4阶段为使用催化剂.下列说法错误的是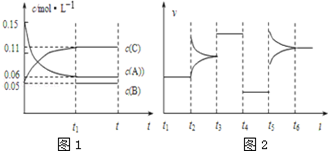
A. 若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 mol•L﹣1•s﹣1
B. t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度
C. B的起始物质的量为0.02 mol
D. 该化学反应的表达式为:3A(g)⇌B(g)+2C(g)
下列图示与对应的叙述不相符的是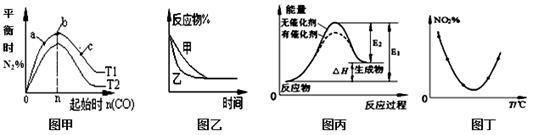
A.图甲表示反应:4CO(g)+2NO2(g) N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 |
B.图乙表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强比甲的压强大 3C(g)+D(g)的影响,乙的压强比甲的压强大 |
| C.图丙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变 |
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2 2NH3,反应过程如下图所示,下列说法正确的是
2NH3,反应过程如下图所示,下列说法正确的是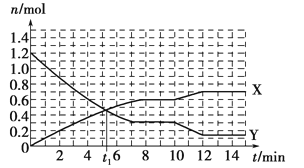
| A.t1 min时正、逆反应速率相等 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
| C.0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1 |
| D.10~12 min,N2的平均反应速率为v(N2)=0.25mol·L-1·min-1 |
可逆反应①X(g)+2Y(g) 2Z(g)②2M(g)
2Z(g)②2M(g) N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示(隔板两侧反应室温度相同)。下列判断正确的是:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示(隔板两侧反应室温度相同)。下列判断正确的是:
| A.反应①的正反应是吸热反应 |
| B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15 |
| C.达平衡(I)时X的转化率为5/11 |
| D.在平衡(I)和平衡(II)中M的体积分数相同 |
可逆反应:2NO2 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)  Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
| 反应时间/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前50 s内的平均速率为v(PCl3)="0.0032" moI·L-l·s-l
B.保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI·L-l,则正反应的△H<0
C.相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正)>v(逆)
D.相同温度下,若起始时向容器中充入1.0mol PCl3、1.0 mol Cl2,则反应达到平衡时PCl3的转化率为80%