将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g) H2(g)+I2(g)。达到平衡时,c(H2)="1" mol·L-1,c(HI)="4" mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)。达到平衡时,c(H2)="1" mol·L-1,c(HI)="4" mol·L-1,则此温度下反应①的平衡常数为( )
| A.22 | B.24 | C.20 | D.25 |
实验室制取甲酸乙酯的反应为: HCOOH+CH3CH2OH HCOOCH2CH3+H2O
HCOOCH2CH3+H2O
反应在该条件下进行时各物质的浓度(mol・L )随时间的变化如下表:
)随时间的变化如下表:
| 时间(min) |
HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
| 0 |
0.3 |
0.7 |
0 |
0.3 |
| 10 |
0.23 |
a |
b |
c |
| 20 |
0.2 |
0.6 |
0.1 |
0.4 |
有关物质在101.3KPa时沸点如下:
| |
HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
| 沸点(℃) |
101 |
78.5 |
54 |
100 |
该反应的化学平衡常数表达为K= ;有关下列叙述不正确的是
;有关下列叙述不正确的是
A.由题给条件不能判断出K值随温度变化是增大还是减小
B.表中a应该等于0.63 mol・L
C.已知50℃下,K=1/3,可由此判断出20min时反应还未达到平衡
D.在起始浓度相同的情况下,要提高产率可采取的措施是适当升高温度将甲酸乙酯蒸出
下图所示与对应叙述相符的是( )
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z Z |
| B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 |
| C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C- |
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图7表示200℃时容器中A、B、C物质的量随时间的变化关系,图8表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图7表示200℃时容器中A、B、C物质的量随时间的变化关系,图8表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1
B.图8所知反应xA(g)+yB(g) zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C.若在图7所示的平衡状态下,再向体系中充入He,此时v正>v逆
D.200℃时,向容器中充入1.6molA和0.8molB,达到平衡时,A的转化率大于50%
一定条件下,通过下列反应可实现燃煤烟气中硫的回收,其中Y是单质。 SO2(g) + 2CO(g) 2X(g)+Y(l),为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
2X(g)+Y(l),为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
| c(SO2)/mol·L-1 |
1.00 |
0.50 |
0.23 |
3.00×10-37 |
3.00×10-37 |
| c(CO)/mol·L-1 |
4.00 |
3.00 |
2.46 |
2.00 |
2.00 |
下列说法不正确的是
A.X的化学式为CO2
B.前1s内v(X)=" 1.00" mol·L-1·s-1
C.该回收原理运用了SO2的还原性
D.该温度下,此反应的平衡常数的数值是3.33×1036
一定条件下,向容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),5 min后反应达到平衡时C(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是
CH3OH(g)+H2O(g),5 min后反应达到平衡时C(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是

| A.0~5 min,CO2的平均反应速率为0.04 mol·(L·min)-1 |
B.反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g)的ΔH<0 CH3OH(g)+H2O(g)的ΔH<0 |
| C.在T2℃时,若反应处于状态D,则一定有v正<v逆 |
| D.若T1℃、T2℃时的平衡常数分别为K1、K2,则K1>K2 |
下列图像与所对应的叙述正确的是
| A.图①表示室温下,用0.1 mol•L-1的氨水吸收HCl气体时,溶液中的粒子浓度随HCl体积的变化。实现表示c(NH3·H2O),虚线表示c(NH4+),处于M点时溶液呈中性 |
B.图②表示2SO2(g)+O2(g)  2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 |
C.图③表示2NH3(g) N2(g) +3H2(g),在恒温恒压的密闭容器中达平衡时N2的物质的量随的 NH3物质的量的变化 N2(g) +3H2(g),在恒温恒压的密闭容器中达平衡时N2的物质的量随的 NH3物质的量的变化 |
D.图④表示AgCl(s) Ag+(aq) +Cl-(aq)的离子浓度关系,当处于b点时,蒸发部分水后,可到达平衡线的a点 Ag+(aq) +Cl-(aq)的离子浓度关系,当处于b点时,蒸发部分水后,可到达平衡线的a点 |
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)⇌PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
| A.反应在前50s的平均速率v(PCl3)=0.0032mol•L-1•s-1 |
| B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 |
| C.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
| D.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆) |
甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是( )
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是( )

| A.脱氢反应的△H<0 |
| B.在t1K时,该反应的平衡常数为8.1 |
| C.600K时,Y点甲醇的υ(正) <υ(逆) |
| D.若增大体系压强,曲线将向上平移 |
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)⇌CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是
| A.温度: T1>T2>T3 |
| B.正反应速率:υ(b)>υ(d) υ(a)>υ(c) |
| C.平衡常数:K(a)>K(c) K(b)=K(d) |
| D.平均摩尔质量: M(b)>M(d) M(a)<M(c) |
下列说法不正确的是
| A.一定温度下,在固定体积的密闭容器中发生可逆反应A(s)+B(g)═C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态 |
| B.对于反应C(s)+CO2(g)═2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率也一定增大 |
C.常温下向0.1mol•L﹣1的NH3•H2O中加入氯化铵固体,则溶液中 减小 减小 |
D.常温下向Mg(OH)2悬浊液中加入MgCl2浓溶液,溶液中 不变 不变 |
某温度下,碳和H2O(g)在密闭容器里发生下列反应:①C(s)+H2O(g) CO(g)+H2(g),②CO(g)+H2O(g)
CO(g)+H2(g),②CO(g)+H2O(g) CO2(g)+H2(g)反应达到平衡时,c(H2)=1.9mol•L﹣1、c(CO)=0.1mol•L﹣1.则下列叙述正确的是
CO2(g)+H2(g)反应达到平衡时,c(H2)=1.9mol•L﹣1、c(CO)=0.1mol•L﹣1.则下列叙述正确的是
| A.CO在平衡时转化率为10% |
| B.平衡浓度c(CO2)=c(H2) |
| C.其他条件不变时,缩小体积,反应②平衡不移动 |
| D.平衡时增大碳的质量,反应①中热量值不变 |
在25℃下,已知反应:①NH3·H2O+H+ NH4+ + H2O(平衡常数为K1);
NH4+ + H2O(平衡常数为K1);
②Ag++2 NH3·H2O Ag(NH3)2++ 2H2O(平衡常数为K2),且K1> K2。下列说法不合理的是
Ag(NH3)2++ 2H2O(平衡常数为K2),且K1> K2。下列说法不合理的是
A.25℃时,将0.02 mol·L-1的氨水与a mol·L-1的盐酸等体积混合(体积变化忽略不计),反应后溶液呈中性,则用含a的代数式表示NH3·H2O的电离常数为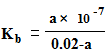 |
| B.往银氨溶液中加水稀释,反应②平衡向逆反应方向移动 |
| C.若往银氨溶液中加入足量的盐酸,则溶液中会产生白色浑浊 |
| D.已知:H+(aq)+ OH-(aq)=H2O(l)DH = -57.3 kJ·mol-1,则1 L 0.1 mol ·L-1氨水和足量的盐酸反应放出的热量等于5.73 kJ |
2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)⇌PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
| A.0.40 mol | B.0.20 mol |
| C.小于0.20 mol | D.大于0.20 mol,小于0.40 mol |
一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| Ⅰ |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
|
|
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
下列说法正确的是( )
A.该反应的正方应为吸热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行