有一可逆反应2A(g)+3B(g) 4C(g)+D(g),已知起始浓度c(A)=2 mol/L,c(B)=3 mol/L,c(C)=c(D)=0,反应开始20 min后达到平衡状态,此时D的平衡浓度为0.5 mol/L,则下列说法不正确的是
4C(g)+D(g),已知起始浓度c(A)=2 mol/L,c(B)=3 mol/L,c(C)=c(D)=0,反应开始20 min后达到平衡状态,此时D的平衡浓度为0.5 mol/L,则下列说法不正确的是
A.前20 min的平均反应速率v(C)=0.1 mol/(L·min)
B.A的转化率为50%
C.C的平衡浓度c(C)=4 mol/L
D.B的平衡浓度c(B)=1.5 mol/L
上图为某化学反应的速率与时间的关系示意图。在t1 时刻改变温度或压强,正逆反应速率的变化都符合示意图的反应是

A.2SO2(g)+O2(g)  2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
C.H2(g)+I2(g) 2HI(g); ΔH>0 2HI(g); ΔH>0 |
D.C(s)+H2O(g) CO(g)+H2(g);ΔH>0 CO(g)+H2(g);ΔH>0 |
一定温度下,两个恒容密闭容器中分别发生反应:
①H2(g)+I2(g) 2HI(g);
2HI(g);
②C(s)+H2O(g) CO(g)+H2(g),
CO(g)+H2(g),
下列状态能表明两反应都达到平衡状态的是
a.各物质的浓度不变;b.容器内气体压强不变;c.容器内气体密度不变;d.容器内气体颜色不变;e.各组分的物质的量分数或质量分数不变;f.混合气体的平均分子量不变;
| A.ae | B.aef | C.abc | D.ac |
已知热化学方程式:aX(g)+3Y(g) bZ(g) △H<0 。现在2L的密闭容器中加入0.9mol的X和1mol的Y,当Y的物质的量减少0.75mol时,达到平衡状态:此时X、Z的浓度分别是0.2mol/L和0.5mol/L,该温度下的平衡常数为
bZ(g) △H<0 。现在2L的密闭容器中加入0.9mol的X和1mol的Y,当Y的物质的量减少0.75mol时,达到平衡状态:此时X、Z的浓度分别是0.2mol/L和0.5mol/L,该温度下的平衡常数为
| A.800 | B.5/4 |
| C.35 | D.20 |
在一定温度下,固定容积的容器中加入a mol A和b mol B,发生反应:A(g)+2B(g) 2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是
2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是
A.再充入少量A,平衡向正反应方向移动,但K值不变
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-0.5n)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar)增大压强,平衡向正反应方向移动
在容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2 2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
| A.等于1.6 mol | B.等于1.2 mol |
| C.大于1.6 mol | D.小于1.2 mol |
已知2SO2(g) + O2(g) 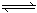 2SO3(g) (正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
2SO3(g) (正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
| A.若降低温度,可以减慢反应速率 |
| B.催化剂虽然能加快化学反应速率,但不能提高SO2的转化率 |
| C.氧气足量时,SO2不能完全转化为SO3 |
| D.达到平衡时,SO2和SO3的浓度一定相等 |
为了控制温室效应,工业上可用CO2来生产甲醇。一定条件下,在体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH>0
CH3OH(g)+H2O(g) ΔH>0
下列说法正确的是
| A.升高温度,该反应的平衡常数增大 |
| B.当v(CO2):v (H2)=1:3时,反应达到平衡 |
| C.当 c(CH3OH) = 1mol·L-1时,反应达到平衡 |
| D.平衡后再充入一定量的CO2,甲醇的体积分数一定增大 |
某温度下,在一个2L的密闭容器中加入4molA和2molB进行如下反应:
3A(g) + 2B(g)  4C(s) + D(g),反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
4C(s) + D(g),反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
A.该反应的平衡表达式是  |
| B.B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动,化学平衡常数不变 |
| D.增加B,平衡正向移动,B的平衡转化率增大 |
在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g) 2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
| A.40% | B.50% | C.60% | D.70% |
将4 mol SO2与2 mol O2放入4L的密闭容器中,在一定条件下反应:2SO2(g)+O2(g) 2SO3(g),测得平衡时SO3的浓度为0.5 mol·L-1。则此条件下的平衡常数K(单位为L·mol-1)为
2SO3(g),测得平衡时SO3的浓度为0.5 mol·L-1。则此条件下的平衡常数K(单位为L·mol-1)为
| A.4 | B.0.25 | C.0.4 | D.0.2 |
在密闭容器中发生反应 aA(g)  cC(g)+dD(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍。下列叙述正确的是
cC(g)+dD(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍。下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a<c+d |
下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
B.反应H2(g) + I2 (g)  2HI(g) 达到平衡后,压缩容器的体积,体系颜色加深 2HI(g) 达到平衡后,压缩容器的体积,体系颜色加深 |
| C.反应CO(g)+NO2(g) = CO2(g)+NO(g) ΔH<0,达平衡后,升高温度体系颜色变深 |
| D.增大压强,有利于SO2与O2反应生成SO3 |
对于反应A(g)+2B(g) 2C(g) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
2C(g) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是