在一密闭容积的容器中进行反应:2SO2(g)+O2(g)  2SO3(g)。
2SO3(g)。 已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4 mol•L-1、0.1 mol•L-1、0.2 mol•L-1。当反应达平衡时,可能存在的数据是( )
已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4 mol•L-1、0.1 mol•L-1、0.2 mol•L-1。当反应达平衡时,可能存在的数据是( )
| A.SO2为0.5mol•L-1,O2为0.2 mol•L-1 | B.SO2为0.2 mol•L-1 |
| C.SO2、SO3均为0.3mol•L-1 | D.SO3为0.4 mol•L-1 |
25℃时,向V mL pH=a的盐酸中,滴加p H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是
H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是
| A.13 | B.14 | C.15 | D.不能确定 |
在密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g),达到平衡后,
cZ(g)+dW(g),达到平衡后, 保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述不正确的是
保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述不正确的是
| A.a+b>c+d | B.平衡向逆反应方向移动 |
| C.Z的体积分数减小 | D.X的转化率下降 |
一定温度 下, 向aL的密闭容器中加入2molNO2(g), 发生如下反应:2NO2
下, 向aL的密闭容器中加入2molNO2(g), 发生如下反应:2NO2 2NO+O2,此反应达到平衡的标志是 ( )
2NO+O2,此反应达到平衡的标志是 ( )
| A.单位时间内生成2nmolNO同时生成2nmolNO2 |
| B.混合气体中NO2、NO和O2的物质的量之比为2:2:1 |
| C.单位时间内生成2nmolNO同时生成nmolO2 |
| D.混合气体的颜色变浅 |
两个完全相同的恒容容器A和B,已知A装有SO2和O2各1g,B中装有SO2和O2各2g,在相同温度下达到平衡,设A中SO2的转化率为a% ,B中SO2的转化率为b%,则A、B两个容器中SO2的转化率的关系是
A.a%> b% B.a%= b%
C.a%< b% D.无法确定
下列说法正确的是
| A.ΔH<0、ΔS>0的反应在温度低时不能自发进行 |
| B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol可能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
对于0.1mol/L CH3COOH溶液,下列叙述正确的是
| A.加入水时,平衡逆反应方向移动 |
| B.加入少量的NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol/L HCl溶液,溶液中C(H+)减少 |
| D.加入少量CH3COONa 固体,平衡向正反应方向移动 |
25 ℃时,水的电离达到平衡:H2O  H+ + OH-;ΔH > 0 ,下列叙述正确的是
H+ + OH-;ΔH > 0 ,下列叙述正确的是
| A.向水中加人稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加人少量固体NaOH,平衡正向移动,c(OH-)升高 |
| D.将水加热,Kw增大,pH不变 |
T℃时,有甲.乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲.乙两容器中加入6mol A和3mol B,发生反应如下:
3A(g)+b B(g)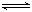 3C(g)+2D(g),(b为
3C(g)+2D(g),(b为 3的正整数) 。
3的正整数) 。
4min后甲容器内的反应达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L;
t min后乙容器内的反应达到平衡,B的浓度为0.8mol/L。
根据题给的信息回答下列问题:
(1)甲容器中反应的平均速率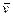 (B)= 。
(B)= 。
(2)在温度T℃时,该反应的化学平衡常数为__________________.
由下表数据可知该反应为______________(填“吸热”“放热”)反应。
化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8mol/L,起始时,向丙容器中加入C、D的物质的量分别为3mol.2mol,则还需加入A.B的物质的量分别是___________.___________。
某温度下,反应N2O4(g)  2NO2(g);(△H>0)在密闭容器中达到平衡.下列说法不正确的是
2NO2(g);(△H>0)在密闭容器中达到平衡.下列说法不正确的是
| A.加压时(体积变小),将使正反应速率增大 |
| B.保持体积不变,加入少许NO2,将使正反应速率减小 |
| C.保持体积不变,加入少许N2O4,再达平衡时颜色变深 |
| D.保持体积不变,升高温度,再达平衡时颜色变深 |
一定条件下,在某密闭容器中,有下列可逆反应:
2X(g)+Y(g) 2Z(g);△H<0,下列有关该反应的说法中
2Z(g);△H<0,下列有关该反应的说法中 正确的是 ( )
正确的是 ( )
| A.该反应的正反应为吸热反应 |
| B.当各物质浓度不再变化时,反应达到平衡状态 |
| C.若温度不变,平衡后把容器的体积增大一倍,平衡将不移动 |
| D.若升高温度,平衡向正反应的方向移动 |