氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应 的化学方程式为 ,平衡常数表达式为 。
(3)由N2O和NO反应生成N2和NO2的能量变化如下图所示, 若生成1molN2,计算该过程的△H= kJ·mol-1。

已知2SO2(g)+O2(g) 2SO3(g) ΔH=-a kJ/mol (a>0),在一个装有催化剂的2L的密闭容器中加入2 mol SO2和1 mol O2,在T ℃时充分反应,10s后达平衡状态,测得容器内气体压强为起始压强的5/6,放出热量为b kJ。
2SO3(g) ΔH=-a kJ/mol (a>0),在一个装有催化剂的2L的密闭容器中加入2 mol SO2和1 mol O2,在T ℃时充分反应,10s后达平衡状态,测得容器内气体压强为起始压强的5/6,放出热量为b kJ。
(1)计算:10s内该反应的平均速率v(O2)=______________,平衡常数K=______________。
(2)比较a b(填“>”“=”或“<”,下同),已知T1 ℃时,该反应的平衡常数K=16,由此可推知, T1___________T。
(3)若在原来的容器中,只加入2 mol SO3,T ℃时充分反应达平衡后, 吸收热量为c kJ,则a、b、c之间满足何种关系 (用代数式表示)。
(4)若相同条件下,向上述容器中分别通入x mol SO2 (g)、y mol O2 (g)、z mol SO3 (g),欲使达到新平衡时容器内气体压强仍为起始压强的5/6。
①x、y、z必须满足的关系是 、 ;
②欲使起始时反应表现为向正反应方向进行,则x的取值范围是 。
(5)将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol SO2和1 mol O2,T ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”“=”或“<”)。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g) + NaCl(s) NaNO3(s) + ClNO(g) K1 ∆H < 0 (I)
NaNO3(s) + ClNO(g) K1 ∆H < 0 (I)
2NO(g) + Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g) + 2NaCl(s)  2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”、“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2 + 2NaOH ="=" NaNO3 + NaNO2 + H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol·L‾1的CH3COONa溶液,则两溶液中c(NO3—)、c(NO2—)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10—4mol·L‾1,CH3COOH的电离常数K a=1.7×10—5mol·L‾1),可使溶液A和溶液B的pH相等的方法是 (选填序号)。
| A.向溶液A中加适量水 | B.向溶液A中加适量NaOH |
| C.向溶液B中加适量水 | D.向溶液B中加适量NaOH |
在一个容积为6L的密闭容器中,放入3LX(g)和2LY(g),在一定条件下发生反应:4X(g)+nY(g) 2Q(g)+6R(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应中的n值是
2Q(g)+6R(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应中的n值是
| A.3 | B.4 | C.5 | D.6 |
A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8。请回答:
(1)试写出B2单质的电子式为           。试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式               。
(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液,其离子方程式是                           。
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色单质,且产物对大气无污染,其化学反应方程式是                             。
(4)在2 L的密闭容器中,通入2 mol B2气体和3 mol A2气体,一定温度下反应生成BA3气体,当反应达到平衡时,A2的浓度为0.15 mol·L-1,同时放出约83.2 kJ的热量,该反应的热化学方程式为                                                       。
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式              ;若0.1 mol该化合物完全反应,转移电子的物质的量为             。
向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3——t4阶段为使用催化剂。观察下图,回答下列问题:
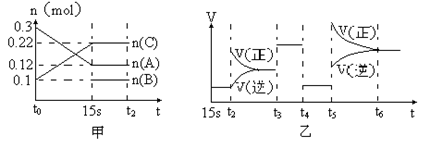
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为 。
(2)乙图中t2时引起平衡移动的条件是 ,t5时引起平衡移动的条件是 。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是 。
(4)该反应的化学方程式可以表示为: ,正反应为 (填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为 。
下列图像与所对应的叙述正确的是
| A.图①表示室温下,用0.1 mol•L-1的氨水吸收HCl气体时,溶液中的粒子浓度随HCl体积的变化。实现表示c(NH3·H2O),虚线表示c(NH4+),处于M点时溶液呈中性 |
B.图②表示2SO2(g)+O2(g)  2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 |
C.图③表示2NH3(g) N2(g) +3H2(g),在恒温恒压的密闭容器中达平衡时N2的物质的量随的 NH3物质的量的变化 N2(g) +3H2(g),在恒温恒压的密闭容器中达平衡时N2的物质的量随的 NH3物质的量的变化 |
D.图④表示AgCl(s) Ag+(aq) +Cl-(aq)的离子浓度关系,当处于b点时,蒸发部分水后,可到达平衡线的a点 Ag+(aq) +Cl-(aq)的离子浓度关系,当处于b点时,蒸发部分水后,可到达平衡线的a点 |
铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 |
平衡常数 |
温度 |
|
| 973K |
1173K |
||
| ⅠFe(s)+CO2(g)= FeO(s)+CO(g) |
K1 |
1.47 |
2.15 |
| ⅡFe(s)+H2O(g)= FeO(s)+H2(g) |
K2 |
2.38 |
1.67 |
| ⅢCO(g)+H2O(g)= CO2(g)+H2(g) |
K3 |
? |
? |
完成下列填空:
(1)反应Ⅰ是________(选填“吸热”,“放热”)反应。根据反应Ⅰ与Ⅱ可以推导出同温下K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)973K时,若反应Ⅲ在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)=__________。若压缩容器的容积为原来的一半,平衡将________移动(选填“向左”,“向右”,“不”),CO2的浓度将________(选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有________。
一定温度下将0.2 mol气体A充入10 L恒容密闭容器中,进行反应:
2A(g)+B(g) 2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
2C(g)+D(s) △H<0,一段时间后达到平衡,此反应过程中测定的数据如下表所示,则下列说法正确的是
| t/min |
2 |
4 |
6 |
8 |
10 |
| n(A)/mol |
0.16 |
0.13 |
0.11 |
0.10 |
0.10 |
A.反应前2 min的平均速率ν(C) ="0.02" mol·L-1·min-1
B.平衡后降低温度,反应达到新平衡前ν(逆)> ν(正)
C.其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小
D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同
已知某可逆反应 mA(g)+ nB(g)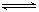 pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )

| A.T1<T2、P1>P2、m+n>p,△H <0; |
| B.T1>T2、P1<P2、m+n>p,△H >0; |
| C.T1>T2、P1<P2、m+n<p,△H >0; |
| D.T1<T2、P1>P2、m+n<p,△H <0; |
在体积不变的绝热密闭容器中,2molSO2与1molO2在催化剂作用下发生反应:2SO2(g)+ O2(g) 2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
| A.增大氧气浓度,平衡正向移动,平衡常数不变 |
| B.降低温度,正反应速率比逆反应速率减小的程度小 |
| C.平衡时SO2气体的转化率为50% |
| D.该条件下反应放出0.5QkJ的热量 |
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积减小的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
有效利用现有资源是解决能源问题的一种实际途径,发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:

(1)以CO和CO2分别与H2为原料,在一定条件下均可合成甲醇(CH3OH)。你认为用哪种合成设计路线更符合“绿色化学”理念:(用化学反应方程式表示)____________;
(2)下图表示在恒容容器中230℃催化剂条件下,0.5molCO2和1.5molH2反应得到甲醇蒸气,产率达80%时的能量变化示意图。

①写出该反应的热化学方程式:_____________________。
②能判断该反应达到化学平衡状态的依据是_____________________。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中气体密度不变
(3)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:负极______。

(4)“催化还原”反应制乙二醇(HOCH2-CH2OH)原理如下:
CH3OOC-COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究,下图表示乙二醇达平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线丙对应的压强时P(丙)=___________。

(5)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸。H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示曲线①代表的粒子是___________;草酸氢钾溶液中存在如下平衡:H2O H++OH-,HC2O4-
H++OH-,HC2O4- H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)
H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)

工业合成氨反应的能量变化如图所示。

(1)写出合成氨反应的热化学方程式:
(2)在甲乙两个体积均为2L固定容积的密闭容器中,分别充入甲:1molN2、3molH2和乙:1molN2、3molH2、1molHe,(其它条件相同),反应速率甲 乙(填大于、小于或等于),经过足够长的时间后在甲容器中该反应放出的热量(或吸收的热量) 92.4kJ(填“大于”、 “小于”或“等于”)
(3)下列图像分别代表焓变(△H )、混合气体平均相对分子质量(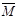 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。

向2L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:
2NO(g)+C(s) N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时数据如下:
N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时数据如下:
| 温度/℃ |
n(活性炭)/mol |
n(CO2)/mol |
| T1 |
0. 70 |
_______ |
| T2 |
_______ |
0.25 |
下列说法不正确的是
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K=9/16
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D.T2℃时,若反应达平衡后再缩小容器的体积,c(N2)/c(NO)不变