矿物燃料在使用的过程中会产生大量污染性物质,如SO2和CO2,而H2和NH3都被认为是理想的清洁能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0(M表示某种合金)如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系.则下列说法中,正确的是___________;
a.T1>T2
b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动
d.上述反应可实现多次储存和释放氢气

(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如图2装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体.图2乙装置中a、b为石墨电极,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。
①工作过程中,甲装置中d电极上的电极反应式是________________;乙装置中电极a为_______极(填电极名称)。
②若在a极产生112mL(标准状况)气体,25℃时乙装置中所得溶液pH=__________。(忽略电解前后溶液的体积变化)
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质.
已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1 2H2(g)+O2(g)═2H2O(1)△H=-572KJ•mo1-1试写出氨气在氧气中燃烧生成液态水的热化学方程式________________;
(4)在一定条件下,将lmolN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)+3H2(g) 2NH3(g)△H<0 已知5分钟后达到平衡,平衡时氨气的体积分数为25%。
2NH3(g)△H<0 已知5分钟后达到平衡,平衡时氨气的体积分数为25%。
①该反应的平衡常数表达式为:K=______________;
②能判断该反应是否达到化学平衡状态的依据是____________
a、容器中压强不变 b、混合气体的密度不变 c、3v正(H2)=2v逆(NH3) d、c(N2): c(H2): c(NH3)=1:3:2
③对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的___________
a、选用更高效的催化剂 b、升高温度 c、及时分离出氨气
d、增加H2的浓度 e、充入He,使体系总压强增大
(1)将1.8g碳置于2.24L(标准状况)O2中充分燃烧,至全部反应物耗尽,测得放出热量30.65kJ,已知:C(s)+O2(g) CO2(g) △H=-393.0 kJ·mol—1,请写出CO完全燃烧的热化学方程式 。
CO2(g) △H=-393.0 kJ·mol—1,请写出CO完全燃烧的热化学方程式 。
(2)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g) COCl2(g) △H<0制备。右图为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g) △H<0制备。右图为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线。回答下列问题:

①若保持温度不变,在第8min 加入体系中的三种物质各1mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
②若将初始投料浓度变为c(Cl2)=0.8mol/L、c(CO)=0.6 mol/L、c(COCl2)= mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
③比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8) T(15)(填“<”、“>”或“=”)。
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g) + 6H2(g)  CH3OCH3(g) + 3H2O(g)。
CH3OCH3(g) + 3H2O(g)。
①已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图:在其他条件不变时,请在右图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。

②二甲醚(CH3OCH3)燃料电池可以提升能量利用率,二甲醚酸性介质燃料电池的负极反应式为 。
(4)常温下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka= (用含和的代数式表示)。
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 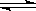 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示,已知Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示,已知Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是:
| A.b>f |
| B.平衡常数K(1000℃)<K(810℃) |
| C.915℃、2.0MPa该反应的平衡常数为Kp=4.5MPa |
| D.1000℃、3.0MPa时E的转化率为83% |
合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6 L NH3时,放出的热量为________。
2NH3(g) ΔH=-92.2 kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6 L NH3时,放出的热量为________。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示。由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1__________K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡__________移动(填“向左”、“向右”或“不”)。
②见右图,T2温度时,在1 L的密闭容器中加入2.1 mol N2、1.5 mol H2,经10 min达到平衡,则v(H2)=________mol/ (L.min)达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4 mol,则平衡________移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(l)+CO(NH2)2(l) ΔH,在一定压强下测得如下数据:
H2O(l)+CO(NH2)2(l) ΔH,在一定压强下测得如下数据:
①则该反应ΔH______0,表中数据a______d,b______f(均选填“>”、“=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?_________________。
关于平衡常数表达及影响因素的易混易错题组
运用化学反应原理研究碳、氮等单质及其化合物的反应有重要意义。
(1)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2分析,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(2)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
①4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
②为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。
(3)25℃时,反应2CO2(g) 2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。
2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。

高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇: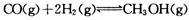 ,若在温度和容器相同的三个密闭容器中,按不同方式投人反应物,测得反应达到平衡吋的有关数据如下表,则下列关系正确的是
,若在温度和容器相同的三个密闭容器中,按不同方式投人反应物,测得反应达到平衡吋的有关数据如下表,则下列关系正确的是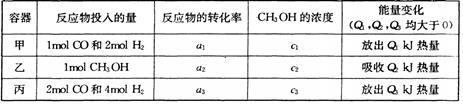
| A.a1+a3=1 | B.2Q1=Q3 | C.c1=c2 | D.2a1=a3 |
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示: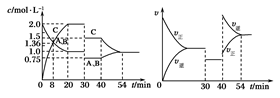
下列说法中正确的是
| A.30~40 min间该反应使用了催化剂 |
| B.反应方程式中的x=1,正反应为吸热反应 |
| C.8 min前A的平均反应速率为0.08 mol·L-1·min-1 |
| D.30 min时降低温度, 40 min时升高温度 |
开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题。甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g) CH3OH(g) ∆H ="-105" kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g) ∆H ="-105" kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
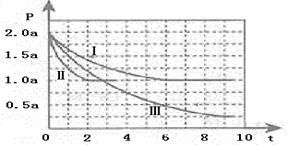
(1)①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在6 min时达到平衡,在此条件下从反应开始到达到平衡时v (CH3OH) = 。
③反应Ⅱ在2 min时达到平衡,平衡常数K(Ⅱ)= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后v(正)_______ v (逆)。(填“>”“<”“=”),原因是:_______________________。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是________________________。
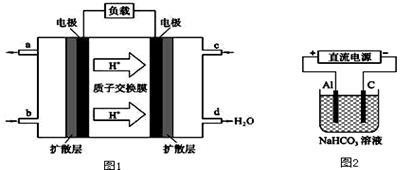
(2)某研究所组装的CH3OH﹣O2燃料电池的工作原理如图1所示。
①该电池负极的电极反应式为: 。
②以此电池作电源进行电解,装置如图2所示。发现溶液逐渐变浑浊并有气泡产生,其原因是 (用相关的离子方程式表示)。
化学反应原理是中学化学学习的重要内容。请回答下列问题:
(1)下列判断正确的是______________。
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH2
则ΔH1﹤ΔH2
②H2(g)+ O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
则ΔH1﹤ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1﹤Q2
④CaCO3(s)===CaO(s)+CO2(g)ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s)ΔH2
则ΔH1﹤ΔH2
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)
设计的原电池如图所示。

请回答下列问题:
①铜电极发生的电极反应为_____________________。
②溶液中Cu2+向________极移动。
(3)在一恒温、恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g)  CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。

回答下列问题:
①Y的化学式是 。
②反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率,v(H2)= mol·L-1·min-1。
③能证明该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积分数保持不变 |
| B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) |
| D.混合气体的平均相对分子质量不变 |
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(4)室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如下图所示。下列有关溶液中离子、分子浓度大小关系的描述中正确的是____________。
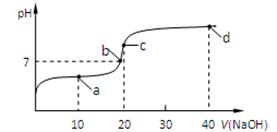
①.a点时:c(CH3COOH) >c(CH3COO-) > c(Na+) > c(H+) >c(OH-)
②.b点时:c(Na+)=c(CH3COO-) >c(H+) =c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)> c(CH3COO-) > c(OH-) >c(H+)
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2+ 3H2 2NH3。
2NH3。
(1)若反应进行5min时,测得n(N2) = 1.8mol,n(NH3) = 0.4mol。
计算:①a的值; ②用H2浓度的变化表示的反应速率。
(2)反应达平衡时,混合气体的总物质的量为5.0mol,其中NH3的含量(体积分数)为40%。
计算:上述温度下该反应的化学平衡常数。
下列图像能正确地表达可逆反应3A(g) + B(g) 2C(g) (△H<0) 的是
2C(g) (△H<0) 的是
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 |
H+ |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
未测定 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH约为 。
(2)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料。
已知:2H2(g)+O2(g)=2H2O(g) K1 2C(s)+O2(g)=2CO(g) K2
2C(s)+2H2O(g)=2CO(g)+2H2(g) K 则K=_____________(用含K1、K2的式子表示)。
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化,已知汽缸中生成NO的反应为:
N2 (g)+O2(g) 2NO(g) △H
2NO(g) △H 0
0
目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
在图1所示密闭容器中充满红棕色的NO2气体,当迅速将活塞向右推一段距离后保持活塞不动时,色度计测出颜色变化的情况如图2所示。如果迅速将活塞往左拉一段距离后保持活塞不动时,色度计测出颜色变化的情况正确的图示为

 |
 |
 |
 |
| A. |
B. |
C. |
D. |
汽车尾气中NO产生的反应为:N2(g)+O2(g) 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
A.温度T下,该反应的平衡常数K=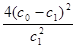 |
| B.温度T下,随着反应的进行,混合气体的密度减小 |
| C.曲线b对应的条件改变可能是加入了催化剂 |
| D.若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g);△H1
CH3OH(g);△H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H2
CH3OH(g)+H2O(g);△H2
③CO2(g)+H2(g) CO(g)+H2O(g);△H3
CO(g)+H2O(g);△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 |
H-H |
C-O |
CO的键能 |
H-O |
C-H |
| E/(kJ.mol-1) |
436 |
343 |
1076 |
465 |
413 |
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
|
