下列反应适用于实验室制备氧气的是 ( )
①高锰酸钾热分解
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
②硝酸铵热分解
2NH4NO3 4H2O+2N2↑+O2↑
4H2O+2N2↑+O2↑
③过氧化氢催化分解2H2O2 2H2O+O2↑
2H2O+O2↑
④二氧化氮热分解2NO2 2NO+O2
2NO+O2
| A.只有① | B.①和② | C.①和③ | D.①③④ |
下图所示为常见气体制备、分离、干爆和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,、
为活塞)。








(1)若气体入口通入和
的混合气体,
内放置
,选择装置获得纯净干燥的
,并验证其还原性及氧化产物,所选装置的连接顺序为(填代号)。能验证
氧化产物的现象是。
(2)停止和
混合气体的通入,E内放置
,按
装置顺序制取纯净干燥的
,并用
氧化乙醇。此时,活塞
应,活塞
应。需要加热的仪器装置有(填代号),
中反应的化学方程式为。
(3)若气体入口改通空气,分液漏斗内改改加浓氨水,圆地烧瓶内改加 固体,
内装有铂铹合金网,按
装置程序制取干燥氧气,并验证氨的某些性质。
①装置中能产生氨气的原因有。
②实验中观察到内有红棕色气体现出,证明氨气具有性。
可用于鉴别以下三种化合物的一组试剂是( )

乙酰水杨酸 丁香酚 肉桂酸
① 银氨溶液 ② 溴的四氯化碳溶液 ③ 氯化铁溶液 ④ 氢氧化钠溶液
| A.②与③ | B.③与④ | C.①与④ | D.①与② |
下列叙述中不正确的是( )

| A.可用装置①鉴别碳酸钠和碳酸氢钠 |
| B.可用装置②分离汽油和水的混合物 |
| C.可用装置③从海水中蒸馏得到淡水 |
| D.可用装置④把胶体粒子从分散系中分离出来 |
下面是实验室制取氧气、氢气、二氧化碳的装置图,根据装置图回答下列问题:

(1)写出标有①、②序号的仪器的名称:①____ ②____
(2)实验室制取氧气时,可选用的发生装置是____;因为氧气不易溶于水,所以可用____装置收集(写装置代号以下同)
(3)实验室收集氢气时,可选用的装置是____和____。
(4)装置B是实验室制取____和____气体的发生装置。
下图Ⅰ、II、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回求答下列问题:
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择 ;(填序号)
若用NH4Cl和Ca(OH)2反应制NH3,则可选择 ;(填序号)
若用MnO2与浓盐酸反应制取氯气,应选用装置 ,(填序号)用离子方程式表示制取氯气的反应原理是 。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满的方法是 。
(3)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为 mol/L。
Ⅰ.实验室常用加热氯化铵和熟石灰两种固体混合物来制取氨气,其反应的化学方程式:
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。问:
CaCl2+2NH3↑+2H2O。问:
(1)实验室制取(不包括收集)氨气的装置,可选用制取__ __(H2或O2或CO2)的装置。其理由是___ _,收集氨气可用_ ___法。
(2)若要制得干燥的氨气,可用_ ___做干燥剂。
(3)写出氨气与氧气反应的化学方程式:__ __。
(4)将氨气溶于水制成氨水,应选用下图装置中的_ ___(填序号)。
A B C
ⅠⅠ.实验室合成氨装置如右图所示,试回答
(1)装置甲的作用是:
① ,② ,③ 。
(2)从乙处导出的气体是 ,检验产物的简单化学方法
。
Ⅲ.实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,反应式为:
NaNO2+NH4Cl=NaCl+N2↑+2H2O↑+Q
实验装置如下图所示,试回答:
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是_______(填写编号)
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.使NaNO2饱和溶液容易滴下
(2)加热前必须进行的一个操作步骤是___________,加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 。
(3)收集N2前,必须进行的步骤是(用文字说明) ,收集N2最适宜的方法是(填写编号) 。
a.用排气法收集在集气瓶中
b.用排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中
从固体混合物A出发可以发生如下框图所示的一系列变化:

(1)在实验室中常用反应①制取气体C。若要收集气体C,可选择下图装置中的 (填字母)

A B C
(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 。
(3)写出下列反应的方程式:
反应①的化学方程式
反应③的化学方程式
(4)在实验室中,要获得干燥纯净的黄绿色气体F, 可以将它通过下图中的装置,其中瓶I中盛放的是 ,瓶II中盛放的是 。
 |
(5)实验中必须吸收多余的气体,以免污染空气。下图是实验室NaOH溶液吸收气体F的装置,为防止发生倒吸现象,合理的装置是 (填选项字母)

A B C
已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于氨气吸收的是( )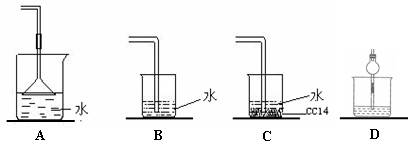
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:


 (1)请列举海水淡化的两种方法、。
(1)请列举海水淡化的两种方法、。
 (2)将
(2)将溶液进行电解,在电解槽中可直接得到的产品有
、、、或
、。
 (3)步骤Ⅰ中已获得
(3)步骤Ⅰ中已获得,步骤Ⅱ中又将
还原为
,其目的为。
 (4)步骤Ⅱ用
(4)步骤Ⅱ用水溶液吸收
,吸收率可达95%,有关反应的离子方程式为,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。
 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:


 请你参与分析讨论:
请你参与分析讨论:
 ①图中仪器
①图中仪器的名称:。
 ②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。
 ③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。
 ④
④中液体产生颜色为。为除去该产物中仍残留的少量
,可向其中加入
溶液,充分反应后,再进行的分离操作是。
二氧化氯()是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2比,
不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在的制备方法中,有下列两种制备方法:
方法一:↑
↑
方法二↑
↑:
用方法二制备的更适合用于饮用水的消毒,其主要原因是。
(2)用处理过的饮用水(
为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(
)。2001年我国卫生部规定,饮用水中
的含量应不超过0.2
。饮用水中
、
的含量可用连续碘量法进行测定。
被
还原为
、
的转化率与溶液
的关系如图所示。

当≤2.0时,
也能被
还原成
。
反应生成的I2用标准溶液滴定:
①请写出≤2.0时,
与
反应的离子方程式。
②请完成相应的实验步骤:
步骤1:准确量取水样加入到锥形瓶中。
步骤2:调节水样的为7.0~8.0。
步骤3:加入足量的晶体。
步骤4:加入少量淀粉溶液,用溶液滴定至终点,消耗
溶液
。
步骤5:。
步骤6:再用溶液滴定至终点,消耗
溶液
。
③根据上述分析数据,测得该饮用水样中浓度为
用含字母的代数式表示)
④若饮用水中的含量超标,可向其中加入适量的
将
还原成
,该反应的氧化产物是(填化学式)。