以乙烯为初始反应物可制得正丁醇(CH3CH2CH2CH2OH)。
已知两个醛分子在一定条件下可以自身加成。下式中反应物的中间产物(Ⅲ)可看成是由(Ⅰ)中的碳氧双键打开,分别跟(Ⅱ)中的2-位碳原子和2-位氢原子相连而得。(Ⅲ)是一种3-羟基醛,此醛不稳定,受热即脱水而生成不饱和醛(烯醛):
请运用已学过的知识和上述给出的信息写出由乙烯制正丁醇各步反应的化学方程式(不必写出反应条件)____。
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图:
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。
(3)写出下列化学反应的方程式。
①气体发生装置中进行的反应:________________________________________。
②NaOH溶液中发生的反应:__________________________________________ 。
在75℃左右,用HgSO4做催化剂,乙炔可以水化为乙醛。但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液,氧化汞粉末五种物质制乙醛,装置如图所示:
请回答以下问题:
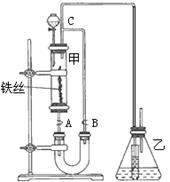
(1)实验开始时,仪器A中盛放电石,B中应装入_______其作用是_______。
(2)仪器D中盛放水,其作用是___________。
(3)蒸馏烧瓶F中应加入氧化汞和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括</PGN0030B.TXT/PGN>氧化汞在内的各试剂的名称:____;将HgO加入F中的操作方法是________。
(4)装置图中,加热F的方式叫____;所选用温度计G的量程表示正确的是________(填序号)。
A.0℃~50℃
B.0℃~100℃
C.0℃~200℃
D.50℃~100℃
E.0℃~360℃
(5)检验乙醛已制出的操作,现象是:____。
用下列实验装置进行相应实验,能达到实验目的的是
| A.用图1所示装置验证浓硫酸具有强氧化性 |
| B.用图2所示装置制取干燥的NH3 |
| C.用图3所示装置制取并收集乙烯 |
| D.用图4所示装置制取Cl2 |
用下图所示的装置制取、提纯并收集表中的四种气体,图中a、b、c表示相应仪器加入的试剂,未考虑尾气处理的问题,其中可行的是( )
| |
气体 |
a |
b |
C |
| A |
 |
浓氨水 |
生石灰 |
碱石灰 |
| B |
 |
稀硝酸 |
铜片 |
碱石灰 |
| C |
 |
浓盐酸 |
浓硫酸 |
氯化钙 |
| D |
SO2 |
浓硫酸 |
铜片 |
硅胶 |
实验室制备下列气体的方法可行的是( )
| |
气体 |
方法 |
| A |
氨气 |
加热氯化铵固体 |
| B |
二氧化氮 |
将铝片加到冷浓硝酸中 |
| C |
硫化氢 |
向硫化钠固体滴加浓硫酸 |
| D |
氧气 |
加热氯酸钾和二氧化锰的混合物 |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
| 选项 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
饱和食盐水 |
MnO2 |
Cl2 |
NaOH溶液 |
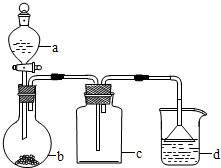
某学生在如下图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题:
(1)第一步,在分液漏斗中依次加入10 mL苯和5 mL液溴,使之混合均匀,此时观察到溴溶于苯,不反应,溶液呈深棕红色。
第二步,打开分液漏斗活塞,将苯、溴混合液按一定速率逐滴加入玻璃管甲中的铁丝上,观察到的现象是剧烈反应,玻璃管甲和导管C中有橙红色蒸气。从上述两步观察到的现象差异,可得出的结论是______________________。
(2)第三步,几分钟后,打开胶皮管夹A和B,使反应混合液流入U形管中,打开管夹B的原因是______________________;然后通过分液漏斗向U形管中加入适量的NaOH溶液,目的是(用化学方程式表示)_ 。
(3)第四步,关闭胶皮管A和B,连同A和B一起取下U形管,用力振荡并静置后,观察到无色的溴苯,它在U形管中液体的_ (填“上”或“下”)层。
(4)要证明上述溴跟苯的反应是取代而不是加成反应,请根据装置乙的作用完成下列各题:
小试管内的液体是__________(填名称)。
锥形瓶内的液体是__________(填名称)。
反应后,向锥形瓶内滴加试剂__________(填名称)溶液,作用是 。
(5)写出上述苯跟溴反应的化学方程式__________________________。
菠菜是一种富含草酸(乙二酸)的绿色蔬菜,但食用时要避免和豆腐同时食用,因为二者容易产生难溶于水的物质而在体内生成结石。草酸也是有机化工中的重要原料,广泛应用于化工生产中。为探究草酸的某些性质,某中学化学兴趣小组查阅了一些资料如下:
| 物质 |
结构 |
某些性质 |
| 草酸 |
分子式:H2C2O4·2H2O |
无色,易溶于水;其钠盐和钾盐易溶于水,钙盐难溶于水 |
| 结构简式:HOOC-COOH |
熔点:101℃;升华温度:125℃;170℃以上分解 |
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
装置C中可观察到的现象是①导管口有气泡出现 ②石灰水变浑浊,由此可知草酸晶体分解的产物有__________。装置B的主要作用是_______________。若无此装置C中可能发生的反应的化学方程式为___________________。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为了进行验证,选用甲组实验中的装置A、B和下图所示的部分装置进行实验。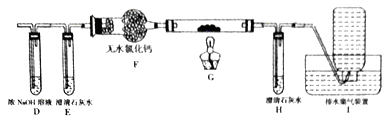
①乙组的实验装置中,装置E和H中的澄清石灰水的作用分别是_________和__________;装置G反应管中盛有的固体物质是___________;I中集气瓶收集到的气体主要是_______________。
②能证明草酸晶体分解产物中有CO的现象是____________________________。
某化学小组用如图所示装置制取氯气。下列说法正确的是
| A.该装置图中至少存在三处明显错误 |
| B.该实验中收集氯气的方法不正确 |
| C.如果需要得到干燥纯净的,只需在气体发生装置和收集装置之间连接一个装有浓硫酸的洗气瓶即可 |
| D.含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定条件下反应,转移1 mol电子 |
如图是收集某气体的装置。由实验装置推测该气体的有关性质可能正确的是

| 选项 |
A |
B |
C |
D |
| 密度比空气 |
大 |
大 |
小 |
小 |
| 溶于水中所得溶液的pH |
>7 |
<7 |
>7 |
<7 |
| 在水中的溶解性 |
大 |
小 |
大 |
小 |
A. A B.B C.C D.D
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是
| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中混有的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制MnCl2•4H2O |
下列操作达不到预期目的的是
①石油分馏时把温度计插入受热的液体中
②用酸性高锰酸钾溶液除去乙炔中含有的H2S
③用乙醇和3%的硫酸共热到170℃制取乙烯
④将苯和溴水混合后加入铁粉制取溴苯
⑤将敞口久置的电石与蒸馏水混合制乙炔
| A.只有①⑤ | B.只有③④⑤ | C.只有①②③⑤ | D.①②③④⑤ |
NaHCO3是重要的化工原料,在实验室里可通过下列两个步骤得到:
已知一些物质在20℃、30℃时溶解度数据:
 溶解度(g) 溶解度(g)温度(℃) |
NH4Cl |
NH4HCO3 |
NaHCO3 |
NaCl |
Na2CO3 |
(NH4)2CO3 |
| 20 |
28.7 |
21.7 |
9.6 |
31.5 |
21.5 |
100 |
| 30 |
41.1 |
27.0 |
11.1 |
36.3 |
39.7 |
>100 |
请回答:
(1)步骤Ⅰ反应的化学方程式是 。
(2)若将NH3和CO2两种气体通入顺序互换后没有沉淀,原因是 。
(3)步骤Ⅱ所得白色沉淀中一定有NaHCO3,原因是 。
(4)步骤Ⅱ生成NaHCO3的离子方程式是 。
(5)根据气体物质溶解性及上列溶解度数据,简述上述两过程在较低温度下进行时效果更好的原因 。