有常温下物质的量浓度均为0.1 mo/L的①氨水②NH4Cl溶液③Na2CO3溶液④NaHCO3溶液,下列说法正确的是
| A.4种溶液pH的大小顺序:①>④>③>② |
| B.等体积的①和②溶液混合后pH>7,c(NH3·H2O)>c( NH4+) |
| C.溶液①、③由水电离产生的c(OH― ):①<③ |
| D.溶液③、④等体积混合后,溶液中c(CO32-)>c(HCO3) |
下列判断不正确的是
A.0.1mol/L的NaHA溶液其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
B.pH=3的盐酸溶液和pH=11的氨水溶液等体积混合后溶液显碱性
C.pH=2的HA溶液与pH=12的MOH溶液任意比例混合后有:c(H+)+c(M+)=c(OH-)+c(A-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后有:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
下列有关叙述正确的是 ( )
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
C.室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中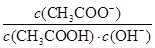 不变 不变 |
| D.在0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
下列说法正确的是( )
| A.室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NAHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.200 0 mol·L-1 NAOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |
25℃时,0.01 mol·L-1两种弱酸溶液的pH如表,下列说法正确的是
| A.相同pH的两种酸溶液中,CH3COOH溶液中水电离的c(H+)较大 |
| B.物质的量浓度相同的CH3COONa与NaCN 溶液中,CH3COONa溶液pH较大 |
| C.等体积pH相同的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH |
| D.HCN的电离平衡常数(Ka)与CN—的水解平衡常数(K)存在如下关系:Ka•K=Kw |
25℃时,将1 mol NH4NO3溶于水,向该溶液滴加b L氨水后溶液呈中性,据此判断下列说法中不正确的是(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
| A.滴加氨水的过程中,水的电离平衡将正向移动 |
| B.滴加b L氨水后的溶液中,n(NH4+) = 200 n(NH3·H2O) = 1 mol |
| C.所滴加氨水的浓度为0.005 / b mol·L-1 |
| D.滴加b L氨水后的溶液中各离子浓度大小是:c(NH4+) = c(NO3-) > c(H+) = c(OH-) |
常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH‑) |
| B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH‑) = c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: |
2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)
下列图示与对应的叙述不相符的是
| A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线 |
| B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 |
C.图3表示压强对可逆反应CO(g)+H2O(g)  CO2(g)+H2(g)的影响,乙的压强比甲的压强大 CO2(g)+H2(g)的影响,乙的压强比甲的压强大 |
| D.图4表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
关于溶液的下列说法正确的是( )
| A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
| C.往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中增大 |
| D.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① |
常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是:( )
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最大
C.A与C等体积混合后,溶液中有c(Cl-)>c(NH4+) >c(H+) >c(OH-)
D.B与D等体积混合后,溶液中有c(OH-)=c(CH3COOH)+c(H+)
下列图示与对应的叙述不相符的是
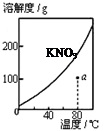
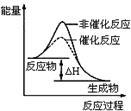
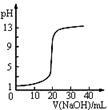
图1 图2 图3 图4
| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线 |
| D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
根据下表数据,下列判断正确的是
| 电离常数(25℃) |
| HF: Ki =" 3.6×10" - 4 |
| H3PO4: Ki1=" 7.5×10" -3, Ki2=" " 6.2×10 -8, Ki3=" " 2.2×10 -13 |
A. 在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+ c(H2PO4-)+ c(OH-)
B. 少量H3PO4和NaF反应的离子方程式为:H3PO4 +F-= H2PO4-+HF
C. 同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4
D. 结合H+ 的能力:H2PO4-> HPO42->F-
某二元酸(H2A)在水中的电离式为:H2A=H+ + HA-,HA- H+ + A2-,则下列说法正确的是( )
H+ + A2-,则下列说法正确的是( )
A.0.1mol/L Na2A溶液中存在的粒子浓度关系:c(A2-) + c(HA-) + c(H2A) = 0.1mol/L
B.0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-) >c(A2-) >c(H+)>c(OH-)
C.若0.1mol/L的NaHA溶液pH=2.0,则0.1mol/L的H2A溶液中,c(H+)<0.11mol/L
D.等物质的量浓度、等体积的H2A和NaOH溶液混合反应后,溶液可能呈中性或碱性
下列说法正确的是( )
| A.室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.200 0 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |
工业上常用还原沉淀法处理含铬废水(Cr2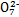 和Cr
和Cr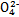 ),其流为:
),其流为:
Cr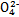
 Cr2
Cr2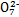
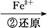 Cr3+
Cr3+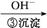 Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr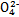 (黄色)+2H+
(黄色)+2H+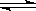 Cr2
Cr2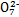 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) 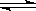 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr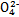 浓度增大 浓度增大 |
B.步骤①中当2v(Cr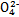 )=v(Cr2 )=v(Cr2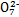 )时,说明反应2Cr )时,说明反应2Cr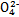 (黄色)+2H+ (黄色)+2H+ Cr2 Cr2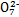 (橙色)+H2O达到平衡状态 (橙色)+H2O达到平衡状态 |
C.步骤②中,若要还原1 mol Cr2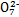 ,需要12 mol (NH4)2Fe(SO4)2·6H2O ,需要12 mol (NH4)2Fe(SO4)2·6H2O |
| D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽 |