在200 mL某硫酸盐溶液中,含有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
A.2 mol·L-1 B.2.5 mol·L-1C.5 mol·L-1 D.7.5 mol·L-1
下列溶液中微粒的物质的量浓度关系正确的是 ( )
| A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性: c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.25℃时,pH =4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合液: c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合: c(HCOO-)+c(H+)<c(Na+)+c(OH-) |
| D.0.1 mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合: |
2 c (CO32-)+2 c (HCO3-)+2 c (H2CO3)="3" c (Na+)
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是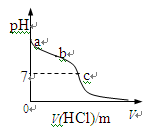
| A.a点:pH=14 |
| B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-) |
| C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1 |
| D.c点后,溶液中离子浓度大小关系一定为: |
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
下列溶液中的Cl-浓度与50mL 1mol/L MgCl2溶液中的Cl-浓度相等的是 ( )
| A.150 mL 1 mol/L NaCl溶液 | B.75 mL 2 mol/L CaCl2溶液 |
| C.150 mL 2 mol/L KCl溶液 | D.75 mL 1 mol/LAlCl3溶液 |
某工厂排放的酸性废水中含有较多量的重金属cu2+,这对农作物和人畜均有害。欲采用化学药剂法除掉有害成分,应选择下列药品中的( )
| A.食盐和硫酸 | B.铁粉和生石灰 |
| C.胆矾和石灰水 | D.苏打和硫酸 |
在25mL0.1mol∙L-1 NaOH溶液中逐滴加入0.1mol∙L-1 CH3COOH溶液,曲线如右图所示,有关粒子浓度关系正确的是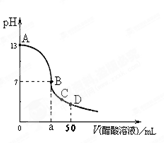
A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B.在B点,a>25,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
Mg(ClO3)2在农业上常用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。下列叙述正常的是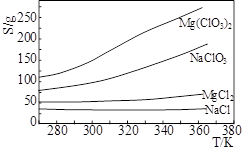
| A.四种化合物的溶解度随温度变化最小的是Mg(ClO3)2 |
| B.300K时,MgCl2的溶解度约为55g |
| C.300K时,100gNaCl饱和溶液中约含有NaCl 36g |
| D.该反应能够进行的条件是生成沉淀,该沉淀是Mg(ClO3)2 |
以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列叙述正确的是()
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2++2e-=Cu
③电路中每通过3.0l×1023个电子,得到的精铜质量为16g
④杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥”
| A.②③ | B.②④ | C.③④ | D.①③ |
下列溶液中微粒浓度关系一定正确的是()
| A.将水加热到120℃,pH=6:c(OH—)< c(H+) |
| B.醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO—)> c(Na+) |
| C.0.lmoI·L-1的硫酸铵溶液中:c(NH+4)> c(SO2-4)> c(H+) |
| D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH—)= c(H+) |
室温时,向稀醋酸中逐滴加入NaOH溶液,正确的是:
| A.向原醋酸中滴入NaOH溶液,可促进CH3COOH的电离,溶液的pH降低 |
| B.当滴入的NaOH与CH3COOH恰好反应时,所得溶液呈中性 |
C.当两者恰好完全反应时: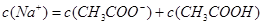 |
D.所得溶液中各离子浓度的关系为: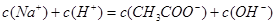 |
下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.下图中pH=7时: c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.下图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)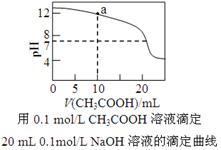
25℃时,水中存在电离平衡:H2O  H++OH- ΔH>0。下列叙述正确的是
H++OH- ΔH>0。下列叙述正确的是
| A.将水加热,Kw增大,pH不变 |
| B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变 |
| C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配合离子 2+ |
| C.向反应后的溶液中加入乙醇,溶液没有发生变化 |
| D.在2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
有一种非常活泼的碱金属的酸式盐AHB,它的水溶液呈弱碱性,现有下列说法,其中正确的是
A.该盐的电离方程式为:AHB A+ + HB- A+ + HB- |
| B.HB-的电离程度大于HB-的水解程度 |
| C.同浓度的AOH溶液和H2B溶液,电离程度:前者大于后者 |
| D.在溶液中离子浓度大小顺序为:c(A+)> c(OH-)>c(HB-) >c(H+)>c(B2-) |