下列关于电解质溶液说法正确的是 ( )
| A.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| B.等体积的pH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB |
| C.常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA‾的电离程度大于其水解程度 |
| D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
下列说法符合事实的是
| A.常温下由水电离产生的c(H+)=10-12mol/L的溶液中加入铝粉都能够产生氢气 |
| B.已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。在含Cl—、CrO42—浓度相同的溶液中滴加几滴稀AgNO3溶液时,则先生成AgCl沉淀 |
| C.电解硫酸铜溶液一段时间后,加入氧化铜固体不可能使溶液恢复到原来的浓度 |
| D.在NaAlO2和Na2CO3的混合溶液中逐滴滴加盐酸直至过量,开始没有沉淀,随后产生沉淀,最后沉淀消失 |
下列叙述中,正确的一组是()
①SO2的水溶液能导电,所以SO2是电解质
②相同温度下,pH相同、体积相同的盐酸和醋酸溶液分别与足量的锌粒反应,醋酸生成的氢气较多
③在0.1mol/L CH3COOH溶液中加水稀释或加入少量CH3COONa晶体,溶液pH均增大
④室温下,将稀氨水逐滴加入到稀硫酸中,当pH=7时,c(NH4+)=c(SO42-)
⑤室温下,将pH=5的硫酸溶液稀释1000倍后,溶液中的SO42-与H+的物质的量浓度之比为1:20
| A.①③④ | B.②④⑤ | C.②③⑤ | D.②③④⑤ |
下列液体均处于25 ℃,有关叙述正确的是( )
| A.Na2CO3溶液中,c(OH-)-c(H+)=c(HCO3-) +2c(H2CO3) |
| B.AgCl在同浓度的MgCl2和KCl溶液中的溶解度相同 |
| C.将稀氨水逐滴加入稀硫酸中,当溶液pH =7时,c(SO42-) >c(NH4+) |
| D.Na2S溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
下列叙述正确的是
| A.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性 |
| B.相同温度下,完全中和相同PH、相同体积的氨水和NaOH溶液,所需相同浓度的盐酸体积相等 |
| C.0.1mol·L-1的酸式盐NaHA溶液中,c(Na+)=0.1mol·L-1≥c(A2-) |
D.向KI溶液中加入氯化银,沉淀逐渐变黄色,说明同温下 |
下列化学实验事实及解释都正确的是()
| A.向Na2SO3溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2SO3溶液已经变质 |
| B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
C.等体积、 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
D.向浓度均为0.1 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(0H)2]>Ksp[Mg(0H)2] 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(0H)2]>Ksp[Mg(0H)2] |
下列有关溶液的说法正确的是
| A.向10mLpH=3的酣酸溶液中加入10mLpH=l1的NaOH溶液,混合液的pH=7 |
| B.实验测定NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>HCO3 |
| C.NH4CI溶液加水稀释过程中c(H+)+c(NH3·H2O)=c(OH一) |
| D.向AgI沉淀中加人饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶 |
下列有关说法中正确的是( )
| A.常温下,将1 L pH=12的氨水加水稀释为10 L后溶液的pH=11 |
| B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V (乙)>10V(甲) |
C.向浓度均为0.1 mol·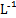 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| D.水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应 |
下列说法正确的是()
A.向Na2CO3溶液通入CO2,可使水解平衡:CO32-+H2O HCO3-+OH-向正反应方向移动,则溶液pH增大 HCO3-+OH-向正反应方向移动,则溶液pH增大 |
| B.室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 |
| C.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| D.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH值 |
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与 碱性悬浊液(含有 )混合,反应生成 ,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被 还原为 ,在暗处静置 ,然后用标准 溶液滴定生成的 ( )。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)"氧的固定"中发生反应的化学方程式为_______________。
(3) 溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取 水样经固氧、酸化后,用 溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗 溶液的体积为 ,则水样中溶解氧的含量为_________mg·L − 1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填"高"或"低")
下列实验操作能达到实验目的的是( )
| A. |
用长颈漏斗分离出乙酸与乙醇反应的产物 |
| B. |
用向上排空气法收集铜粉与稀硝酸反应产生的 NO |
| C. |
配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| D. |
将 与 混合气体通过饱和食盐水可得到纯净的 |
下列有关说法正确的是
A.一定条件下反应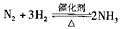 ,达到平衡时, ,达到平衡时,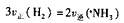 |
| B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成 |
C.将PH=a十l的氨水稀释为pH=a的过程中,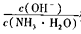 变小 变小 |
| D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
下列叙述正确的是
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液 =7 |
| C. | 25℃时,0.1 的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
| D. | 0.1 和0.1 混合后加入1 水中,所得溶液中 |
下列说法正确的是( )
| A.pH=4的溶液中水电离出的H+一定是1×10-4mol/L |
| B.25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D.AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl) |