某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是
| A.溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.若溶液中部分粒子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性 |
| C.若溶液中溶质仅为CH3COONa,则粒子间一定满足: c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足: |
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.在0.1mol·L-1NaHCO3溶液中:c(Na+)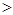 c(HCO3-) c(HCO3-)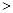 c(CO32-) c(CO32-)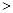 c(H2CO3) c(H2CO3) |
| B.在0.1mol·L-1Na2CO3溶液中:c(OH-)= c(HCO3-)+c(H2CO3)+ c(H+) |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液: c(CO32-)> c(HCO3-)> c(OH-)> c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液呈中性, c(Na+)=0.1mol·L-1: |
c(Na+)= c(CH3COO-)> c(CH3COOH)> c(H+)= c(OH-)
已知25℃时,下列酸的电离常数:
醋酸(CH3COOH):1.75×10-5 氢氰酸(HCN):4.93×10-10
氢氟酸(HF):7.2×10-4 甲酸(HCOOH):1.77×10-4
物质的量浓度均为0.1mol?L-1的上述溶液,酸性最强的是
| A.醋酸 | B.氢氰酸 | C.氢氟酸 | D.甲酸 |
下列有关实验原理,方法和结论都正确的是 ( )
| A.某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀,该钠盐一定是硫酸钠 |
| B.在硫酸钡中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明K10(H2SO4)>K10(BaCO3) |
| C.新制氯水中加入碳酸钙粉末搅拌,过滤、滤液中c(HC1O)将增大 |
| D.相同质量的两份锌粒分别加入足量稀硫酸,在一份中加入少量CuSO4·5H2O,其反应速率将加快,且最终产生的H2与另一份相同 |
标准状况下,VL氨气溶解在1L水中(水的密度近似为1g/ml)所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为cmol/L,则下列关系中不正确的是( )
| A.c=1000ρω/17 | B.ω=17c/1000ρ |
| C.ω=17V/(17V+22400) | D.c=Vρ/(17V+22400) |
在常温下,10mLpH=10的KOH溶液中,加入pH=4的CH3COOH溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
| A.c(CH3COO-)< c (K+) |
| B.c(H+) = c(OH-)< c(K+)< c(CH3COO -) |
| C.V总> 20mL |
| D.V总 < 20mL |
已知达到电离平衡的0.1mol/L的醋酸溶液中,为了促进醋酸的电离,同时使溶液的pH降低,应采取的措施是
| A.加入一定量的水 | B.加热溶液 | C.加入少量盐酸 | D.加入冰醋酸 |
(13分) 现有常温时浓度相同的五种电解质溶液:
①CH3COOH ②Na2CO ③HNO3 ④CH
③HNO3 ④CH COONa ⑤NaOH
COONa ⑤NaOH
(1)五种溶质中是弱电解质的是______(填编号),若常温时该弱电解质电离常数为K,1mol/L的该溶液中c(H+)约为__________mol/L(用K表示)
(2)④溶液中离子与分子共______种(包括水分子)。
(3)这五种溶液的pH由小到大的顺序是______________________________(填编号)。
(4)将 CH COONa溶液稀释100倍时,其pH变化如图中_______曲线(填字母).
COONa溶液稀释100倍时,其pH变化如图中_______曲线(填字母).
(5)上 述五种溶液中分别加入AlCl3溶液,有气泡产生的是 (填编号),写出能产生气泡现象的离子方程式: .
述五种溶液中分别加入AlCl3溶液,有气泡产生的是 (填编号),写出能产生气泡现象的离子方程式: .
将足量的BaCO3分别加入:
①30mL水 ②10mL0.2mol/LNa2CO3溶液
③50m L0.01mol/LBaCl2溶液 ④100mL0.01mol/LHCl溶液
中溶解至溶液饱和,请确定各溶液中Ba2+的浓度由大到小的顺序为( )
| A.①②③④ | B.③④①② | C.④①③② | D.②①④③ |
下列说法正确的是( )
| A.25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW |
| B.SO2通入碘水中,反应的离子方程式为SO2 + I2 + 2H2O = SO42- + 2I- + 4H+ |
| C.加入铝粉能产生H2的溶液中,可能存在大量的Na+、HCO3-、AlO2— 、NO3— |
| D.100℃时,将 pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |