将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02molHBr的溶液中,在此过程中,溶液的[H+]与Cl2用量的关系示意图是(溶液的体积视为不变)( )
已知:还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法正确的是( )
| A.反应过程中的氧化产物均为SO3 |
| B.a点时剩余NaHSO3的物质的量为1.2 mol |
| C.b点时的还原产物可能是KI或NaI |
| D.当溶液中I-与I2的物质的量之比为1:1时,加入的KIO3为1.1 mol |
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(2H2O2 =2H2O+O2↑)为原料制取氧气,当制得相同质量的氧气时,三个反应中转移的电子数之比为
| A.2︰2︰1 | B.1︰1︰1 | C.2︰3︰1 | D.4︰3︰2 |
在氧化还原反应3Cl2+ 6KOH = KClO3 + 5KCl + 3H2O中,被氧化与被还原的氯元素的物质的量之比为
| A.1:1 | B.1:5 | C.2:1 | D.3:2 |
在5KCl+KClO3+3H2SO4  3Cl2↑+3K2SO4+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为:
3Cl2↑+3K2SO4+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为:
| A.1:1 | B.5:1 | C.1:5 | D.3:1 |
在xR2+ +yH+ +O2=mR3+ +nH2O的离子方程式中,对m和R3+判断正确的是( )
| A.m=4,R3+是氧化产物 | B.m=2y,R3+是氧化产物 |
| C.m=2,R3+是还原产物 | D.m=y,R3+是还原产物 |
在反应5NH4NO3 2HNO3 + 4N2 + 9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是( )[
2HNO3 + 4N2 + 9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是( )[
| A.2:8 | B.5:3 | C.5:8 | D.5:4 |
在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O从而可知在RO3n-中,元素R的化合价是( )
A +4 B +5 C +6 D +7
工业上冶炼铁有化学方程式如下:Fe2O3+3CO 2Fe+3CO2,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为( )
2Fe+3CO2,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为( )
| A.3︰1 | B.2︰3 | C.1︰3 | D.3︰5 |
24ml 0.05mol·L-1的Na2SO3溶液恰好与20ml 0.02mol·L-1的K2Cr2O7溶液完全反应,则元素Cr在还原产物中的化合价为( )
| A.+5 | B.+2 | C.+4 | D.+3 |
2010年诺贝尔化学奖授予美日科学家,他们由于研究“有机物合成过程中钯催化交叉偶联”而获奖。钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:CO+PdCl2 +H2O CO2 +Pd↓ +2HC1。下列说法正确的是 ( )
| A.题述反应条件下还原性:CO> Pd | B.题述反应中PdCl2被氧化 |
| C.生成22.4 L CO2时,转移的电子为2 mo1 | D.CO气体只有在高温下才能表现还原性 |
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。横、纵坐标的单位均为mol。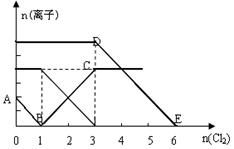
有关说法不正确的是( )
| A.线段BC代表Fe3+ 物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)= 6 mol/L |
| C.当通入Cl22mol时,溶液中已发生的反应可表示为:2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
| D.原溶液中n (Fe2+): n (I━): n(Br━)=2:1:3 |
下列说法正确的是 ( )
| A.当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移 |
| B.SO2气体使品红溶液褪色,表现了SO2的氧化性 |
| C.浓盐酸和MnO2反应时,浓盐酸中的HCl全部被氧化 |
| D.在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为1:2 |