实验室将NaClO3和Na2SO3按物质的量之比为2∶1倒入烧瓶中,同时滴入适量稀H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |
下列方法制取O2:①KClO3(MnO2)受热分解;②KMnO4受热分解;③H2O2中加MnO2,若制得相同质量的O2,反应中上述各种物质(依编号顺序)的电子转移数目之比是
| A.2:1:2: | B.1:1:1 | C.2:2:1 | D.1:2:1 |
溶液中有0.2mol XO ,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价
,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价
为( )
| A.+4 | B.+3 | C.+1 | D.0 |
1.52g铜镁合金完全溶解于50 mL密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1 |
| C.NO2和N2O4的混合气体中,NO2和N2O4的物质的量之比是1:4 |
| D.得到2.54g沉淀时,加入NaOH溶液的体积是640mL |
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如右图所示,下列说法中不正确的是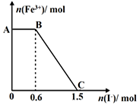
| A.图中AB段的氧化剂为K2Cr2O7 |
| B.图中BC段发生的反应为2Fe3++2I—=2Fe2++I2 |
| C.开始加入的K2Cr2O7为0.25mol |
| D.K2Cr2O7与FeSO4反应的物质的量比为1∶3 |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:
a HClO3 → b O2↑+ c Cl2↑+ d HClO4+ e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法错误的是
| A.由反应可确定:氧化性HClO3>HClO4 |
| B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4C12+ I2+ 6H2O→ 12H++ 8Cl-+ 2IO3- |
| C.若氯酸分解所得的混合气体的平均摩尔质量为47.6g/ mol,则反应方程式可表示为:26HClO3 → 15O2↑+ 8C12↑+ 10HClO4+ 8H2O |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是
| A.Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水 |
| B.Na2FeO4既是氧化产物又是还原产物 |
| C.Na2O2在上述反应中只作氧化剂 |
| D.2 mol FeSO4发生反应时,共有10 mol电子发生转移 |
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )

| A.图中AB段的氧化剂为K2Cr2O7 |
| B.图中BC段发生的反应为2Fe3++2I﹣=2Fe2++I2 |
| C.开始加入的K2Cr2O7为0.25 mol |
| D.K2Cr2O7可与FeSO4反应的物质的量为1:3 |
用0.2 mol/L Na2SO3溶液32 mL,还原含2×10-3mol X2O72-的溶液,过量的Na2SO3用0.1 mol/L KMnO4酸性溶液氧化(其中KMnO4被还原成Mn2+),共消耗KMnO4溶液1.6 mL,则元素X在还原产物中的化合价是
| A.+1 | B.+2 | C.+3 | D.+4 |
已知M2O7x﹣+3S2﹣+14H+ = 2M3++3S↓+7H2O,则M2O7x﹣中的M的化合价为( )
A +2 B.+3 C.+4 D.+6
物质的量之比为2 : 5 的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的稍酸的物质的量之比是
| A.1:4 | B.1:5 | C.2:3 | D.2:5 |
某溶液中含有1.2×10-3 mol XO3-,恰好能氧化30mL 0.1mol/LNa2SO3溶液(形成Na2SO4溶液),则还原产物中元素X的化合价是
| A.0 | B.- 2 | C.+3 | D.+2 |
已知Cu2S与某浓度的硝酸反应时,生成硝酸铜和硫酸,若反应中Cu2S与HNO3的物质 的量之比为2:13,则该反应的还原产物为
| A.N2O | B.NO | C.NO2 | D.N2O3 |
R2O8n-离子在一定条件下可把Mn2+氧化为MnO4-,若反应后R2O8n-离子变RO42-离子, 又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值是
| A.4 | B.3 | C.2 | D.1 |