一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和(SO4)2-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则v可能为(。 )
| A.9.0L | B.13.5L | C.10.7L | D.16.8L |
已知溶液中:还原性: -氧化性
-氧化性 在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )
在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )
| A.a点时NaHSO3过量 |
| B.b点时还原产物为碘离子 |
| C.b点到c点,KIO3与NaHSO3反应生成单质碘 |
| D.加入的KIO3为0.4mol或1.12mol时,反应后溶液中碘离子均为0.4mol |
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50 mg/kg |
| 分装日期 |
|
| 分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处): ___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_____________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.
d.分离出下层液体。
请补充填写上述操作步骤c处应进行的操作。
(3)已知:I2+2S2O32- = 2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液12.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是___________________________________。
②b中反应所产生的I2的物质的量是________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_________mg/kg。
(16分)金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空间技术、航海、化工、医疗上不可缺少的材料。
Ⅰ.工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如下图(部分产物略去):
(1)步骤①反应的化学方程式为:2FeTiO3 + 6C + 7Cl2高温2FeCl3 + 2TiCl4 + 6CO,还原剂是 。
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3 的不同。
(3)步骤④反应的化学方程式为____________,该反应在氩气中进行的理由是____ ______。
(4)绿色化学提倡物料循环。以上流程中,可用于循环的物质除Cl2、Mg外,还有__________。
II. 工业上也可用TiO2通过下述两种方法制备金属钛:
方法一:先将TiO2氯化为TiCl4,再还原得到Ti。
(5)氯化反应TiO2 (s) +2Cl2 (g) TiCl4(l) + O2 (g)无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
TiCl4(l) + O2 (g)无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因: 。
方法二:以熔融盐为电解液电解TiO2获得Ti。其中碳块为阳极,电极反应式为:2O2ˉ4eˉ=O2↑;TiO2作阴极,被还原。
(6)阴极的电极反应式为 。
(7)电解过程中需定期向电解槽中加入碳块的原因是 。
ClO2气体是一种常用的消毒剂,我国从2000年起已逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将Fe2+、Mn2+转化成Fe(OH)3、MnO2难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有 性。
(2)工业上可以通过下列方法制取ClO2,请完成该反应化学方程式:2KClO3+SO2=2ClO2+___。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1—0.8mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样用氢氧化钠溶液调至中性,然后加入一定量的碘化钾,并加入淀粉溶液,溶液变蓝。
II.加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2═S4O62-+2I-)
III.加硫酸调节水样pH至1.3。操作时,不同pH环境中粒子种类如下图所示:
请回答:
①操作I中反应的离子方程式是 。
②确定操作II完全反应的现象是 。
③在操作III过程中,溶液又呈蓝色,反应的离子方程式是 。
④若水样的体积为1.0L,在操作II时消耗了1.0×10-3mol/L的Na2S2O3溶液10mL,则水样中ClO2的浓度是 mg/L。
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)上述流程中可以循环使用的物质有 、 (写化学式)。
(2)若不考虑制备过程中的损失与物质循环,则1 mol MnO2可制得 mol KMnO4;反应中二氧化锰的主要作用是 (“氧化剂”、 “还原剂”、“催化剂”)。
(3)操作I的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
(4)写出母液中加入生石灰苛化时的反应总的离了方程式 .
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代 号) 。
| A.石灰石 | B.稀HC1 | C.稀H2SO4 | D.纯碱 |
所需气体发生装置是 (选填序号)。
计算题(共16分,写出计算过程)
1). 在标准状况下,224mL某气体的质量为0.40 g。试计算这种气体的摩尔质量。
2). 0.5L1 mol/L的CaCl2溶液,与多少L的0.5 mol/L AlCl3的Cl-的物质的量相等?
3). 若需要2.0 mol/LCuSO4溶液100 mL,配制此溶液应称取CuSO4·5H2O的质量是多少? (已知:CuSO4·5H2O的摩尔质量为250g/mol,CuSO4·5H2O ==CuSO4 + 5H2O)
4).在Cu + 2H2SO4(浓) △CuSO4 + SO2↑ + 2H2O中
①氧化剂是 ,氧化产物
②还原剂和氧化剂的物质的量之比是 ;还原性强弱比较:Cu SO2 (填>或<)。
③若反应中消耗2mol Cu,则反应中转移 mol电子。
(16分) 以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。

(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为 。
(2)写出木屑水解反应的化学方程式: 。配平浸出步骤反应方程式C6H12O6 + MnO2 + H2SO4→ MnSO4 + CO2 + H2O
(3)若取消除酸操作步骤,将会产生 气体(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式 ;
(5)取一定量的阳极泥进行实验分析,得到如下图像。硫酸的最合适用量为 mL,若再增加硫酸的用量,将会导致 (填化学式)的消耗量增大。
(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于 L。(假设阳极泥中的其它成分不参与反应)
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:

现称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05000 mol·L-1标准碘溶液进行滴定,初读数为0.10 mL,末读数如右图所示。
(1)冶炼铜的反应为8CuFeS2+ 21O2 高温8Cu + 4FeO + 2Fe2O3+ 16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)装置a的作用是 。
| A.有利于空气中氧气充分反应 | B.除去空气中的水蒸气 |
| C.有利于气体混合 | D.有利于观察空气流速 |
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)滴定时,标准碘溶液所耗体积为 mL。用化学方程式表示滴定的原理: 。
(5)通过计算可知,该黄铜矿的纯度为 。
已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为1︰6,则该反应的还原产物是
| A.NO | B.NO2 | C.N2O | D.NH4NO3 |
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下: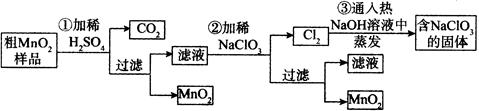
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是
[ ] + [ ]ClO3— + [ ] = [ ]MnO2↓ + [ ]Cl2↑ + [ ] 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、 、 。已知蒸发得到的固体中含有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3。
(12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液,加入Na2S2O3的作用是___________。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_________。
(3)用离子方程式表示过程Ⅳ中Na2CO3的主要作用_______。
(4)下图是CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是______。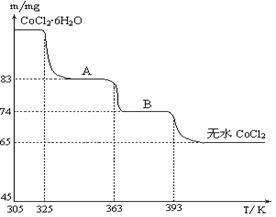
(17分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验: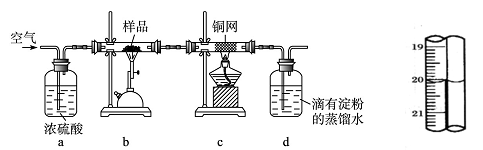
称取研细的黄铜矿样品1.150g,在空气存在的条件下进行煅烧。实验后取d中溶液的1/10置于锥形瓶中,用0.05mo1/L标准碘溶液进行滴定,初读数为0.10mL,终读数如右上图所示。
(1)黄铜矿煅烧的反应为8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2,该反应中被还原的元素是___(填元素符号)。
(2)标准碘溶液应盛放在(填“碱式”或“酸式”)________滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是: 。请用化学方程式表示滴定的原理: 。
(3)滴定终点的读数为 mL;通过计算可知,该黄铜矿的纯度为 。
(4)若去掉c装置,会使测定结果 (填“偏低”“偏高”或“无影响”)。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,可能的原因主要有 。
已知FeS2与某浓度的HNO3反应时生成Fe(NO3) 3、H2SO4和某单一的还原产物,若FeS2和参与反应的HNO3的物质的量之比为1:8,则该反应的还原产物是
| A.NO2 | B.NO | C.N2O | D.NH4NO3 |
在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,固体全部溶解,且还原产物只有NO2和NO。将反应后溶液用蒸馏水稀释至100 mL,测得c(NO3-)=4 mol·L-1。
(1)稀释后的溶液中c(H+)= mol·L-1
(2)若a=10,则生成的气体中NO2的物质的量为________mol
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
若上述混合气体被1 mol·L-1的NaOH溶液恰好吸收,则NaOH溶液的体积为________mL