下列叙述正确的是( )
| A.具有相同的质子数的粒子一定是同种元素 |
| B.有单质参加和生成的反应一定是氧化还原反应 |
| C.凡具有正四面体结构的分子,其键角均为109°28’ |
| D.含有阳离子的物质不一定含有阴离子 |
用数轴表示化学知识,并按某种共性对化学物质进行分类,有简明易记的效果。例如,根据碳素钢的含碳量,将其分为低碳钢、中碳钢、高碳钢,利用数轴分类法可将其表示为:
根据这一分类方法请回答:
(1)将pH与溶液酸碱性的关系粗略地表示在如下数轴上:
(2)某化学兴趣小组欲研究H2SO4、KCl、NaCl、Na2CO3、Na2SO3、NaOH六种物质的性质,对于如何研究,他们设计了两种研究方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。
方法Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7。由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类是否合理?为什么?_____________________________。
②在方案Ⅰ中,某同学发现盐类物质中的KCl、NaCl在与其他物质混合时现象相同,无法区分,请设计一种简单的方法区分这两种物质_____________________________。
③在方案Ⅱ中,三种钠盐用其他物质中的________可加以区分,有关反应的化学方程式分别为_____________________________________________________________________。
④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类。在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3很容易得到了区分,但鉴别NaCl和NaOH时却陷入了困境,请设计一个实验来解决这一难题:__________________________________________。
材料:①今年元月,韩国某冷库在聚氨酶发泡作业时,因可燃性油气挥发而引发爆炸;②同月,我国一旅馆食堂因液化石油气泄露引发爆炸。下列说法中正确的是( )
| A.聚氨酶属于有机高分子化合物,是纯净物 |
| B.可燃性气体与空气混合遇火一定会发生爆炸 |
| C.液化石油气的主要成分是CO |
| D.可燃性气体在空气中燃烧属于氧化还原反应 |
用NA代表阿伏加德罗常数,下列说法正确的是
| A.标准状况下,11.2LSO3所含的分子数为0.5 NA |
| B.1 mol Cl2参加氧化还原反应,转移的电子数目一定是2 NA |
| C.在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2 NA |
| D.46 g二氧化氮和四氧化二氮混合气体中含有的原子数为3 NA |
用蒸汽密度法测定物质的相对分子质量是一种常用的方法。现测得0.2g某挥发性液体化合物样品在挥发时排出的空气在标准状况下是40mL,则该化合物的相对分子质量是

 ( )
( ) 
| A.80 | B.112 | C.168 | D.340 |
将400C的饱和澄清石灰水冷却至10OC,或将其中加入少量CaO(但温度仍能保持400C),在这两种情况下均未改变的量是:
A.溶液的质量 B.溶液中溶质的质量分数 C.溶液中Ca2+的数目 D. Ca(OH)2的溶解度
一定量的氢气在氯气中燃烧,所得混合物用1003.00
溶液(密度为1.12
)恰好完全吸收,测得溶液中含有
的物质的量为0.0500
。
(1)原溶液的质量分数为。
(2)所得溶液中的物质的量为
。
(3)所用氯气和参加反应的氢气的物质的量之比=。
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH===NaNO2+NaNO3+H2O、NO+NO2+2NaOH===2NaNO2+H2O
则生成的盐溶液中NaNO3的物质的量为


| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
我国稀土矿资源丰富,品位甚高。提取稀土元素可以向含RE(RE表示稀土元素)的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转入沉淀。有关的反应为(RE)2(SO4)3+Na2SO4+xH2O (RE)2(SO4)3·Na2SO4·xH2O↓。下列叙述不正确的是( )
(RE)2(SO4)3·Na2SO4·xH2O↓。下列叙述不正确的是( )
| A.该反应属于化合反应 |
| B.该反应属于可逆反应 |
| C.生成的产物在分类上属于复盐 |
| D.RE在化合物中的化合价为+3 |
下列有关化学用语使用正确的是( )
A.CO2的电子式: |
| B.次氯酸的结构式: H—O—Cl |
C.中子数为18的氯原子结构示意图: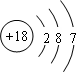 |
| D.二氧化硅的分子式为:SiO2 |
下列叙述不正确的是:
| A.根据金属活动性顺序,可以推断冶炼金属时可能的方法 |
| B.根据元素周期表中元素的位置,可以寻找合适的半导体材料 |
| C.根据元素某种原子的质子数和中子数,可以确定该元素的相对原子质量 |
| D.根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行 |
有关化学用语正确的是( )
| A.乙烯的结构简式CH2CH2 | B.乙醇的结构简式C2H6O |
C.四氯化碳的电子式 |
D.乙酸的分子式C2H4O2 |
以下数据对应的条件不充分的是
| A.25℃时醋酸的电离度:0.1% |
| B.20℃、101.3KPa时HCl在水中的溶解度为 1:442 |
| C.99℃时水的离子积:1×10-12 |
| D.标准状况时氧气的密度:1.429 g/L |
氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
I.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式_____。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示)_______________。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。
写出上述化学反应方程式:_________________________。 II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
(4)下列能表明容器乙一定达平衡状态的是_____(填字母)
| A.容器内的混合气体的平均相对分子质量不再变化 | |
| B.容器内的氮元素的质量不再变化 | |
C.氢气的生成速率与氨气的消耗速率之比为2:3 |
D.形成1mol N N键的同时形成6molN—H键 |
(5)甲容器中氮气的转化率为_____。
(6)起始时,容器乙是容器甲压强的_____倍。