下列关于溶液的说法中,正确的是 ( )
| A.凡是均一、稳定的液体,就是溶液 |
| B.长期放置后不会分层的液体,就是溶液 |
| C.一种物质里分散着另一种物质的液体就是溶液 |
| D.溶液一定是均一、稳定的混合物 |
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表所示。
下列说法中,不正确的是 ( )
| A.由实验①可知,HA为弱酸 |
| B.实验①所得混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| C.实验②所得混合溶液中:c(Na+)=c(A-) |
| D.实验③所得混合溶液中由水电离出的OH-的浓度为1×10-9mol·L-1 |
下列叙述不正确的是 ( )
| A.质量数相同的原子,不一定属于同种元素的原子 |
| B.含有金属元素的离子都是阳离子,非金属元素之间形成的不一定都是共价键 |
| C.ⅣA~ⅦA族中只有ⅦA族元素没有同素异形体 |
| D.活泼金属与活泼非金属形成的化合物不一定都是离子化合物 |
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸):
Cu(NH3)2Ac + CO + NH3 = Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为 ▲ 。
(2)写出基态Cu+的核外电子排布式 ▲ 。
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为 ▲ 。
(4)写出与CO互为等电子体的离子 ▲ 。(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为 ▲ ;1 mol尿素分子中,σ键的数目为 ▲ 。
(6)铜金合金形成的晶胞如上图所示,其中Cu、Au原子个数比为 ▲ 。
【苏北四市2009届高三第三次调研考试化学】下列化学用语正确的是
| A.硝基苯的结构简式: |
B.S2- 的结构示意图:  |
| C.丙烷的分子结构模型示意图: |
| D.16O与18O互为同位素,H216O、D216O、H218O、D218O互为同素异形体 |
某温度下,向PH=6的纯水中加入一定量的盐酸,保持温度不变,测得溶液的pH=2,对于该溶液,下列叙述中不正确的是
| A.将该盐酸温度降低,pH不变 |
| B.该溶液的浓度c(HCl)="0.01" mol·L-1 |
| C.该溶液中水电离产生的c(H+)=10-10 mol·L-1 |
| D.该温度下加入等体积pH=12的NaOH溶液,即可恰好完全中和 |
下列各组反应中,所得产物相同的是
A.金属钠在常温或加热时与氧气反应 |
B.氯化铝溶液与少量氨水或过量氨水反应 |
C.金属铜与浓硝酸或稀硝酸反应 |
D.溴乙烷与烧碱的水溶液或烧碱的醇溶液反应 |
物质的量浓度相同的下列溶液,由大到小排列正确的是()
| A. |
|
| B. |
|
| C. |
|
| D. |
|
我国稀土矿资源丰富,品位甚高。提取稀土元素可以向含RE(RE表示稀土元素)的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转入沉淀。有关的反应为(RE)2(SO4)3+Na2SO4+xH2O (RE)2(SO4)3·Na2SO4·xH2O↓。下列叙述不正确的是( )
(RE)2(SO4)3·Na2SO4·xH2O↓。下列叙述不正确的是( )
| A.该反应属于化合反应 |
| B.该反应属于可逆反应 |
| C.生成的产物在分类上属于复盐 |
| D.RE在化合物中的化合价为+3 |
下列有关化学用语使用正确的是( )
A.CO2的电子式: |
| B.次氯酸的结构式: H—O—Cl |
C.中子数为18的氯原子结构示意图: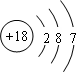 |
| D.二氧化硅的分子式为:SiO2 |
下列叙述不正确的是:
| A.根据金属活动性顺序,可以推断冶炼金属时可能的方法 |
| B.根据元素周期表中元素的位置,可以寻找合适的半导体材料 |
| C.根据元素某种原子的质子数和中子数,可以确定该元素的相对原子质量 |
| D.根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行 |
有关化学用语正确的是( )
| A.乙烯的结构简式CH2CH2 | B.乙醇的结构简式C2H6O |
C.四氯化碳的电子式 |
D.乙酸的分子式C2H4O2 |
以下数据对应的条件不充分的是
| A.25℃时醋酸的电离度:0.1% |
| B.20℃、101.3KPa时HCl在水中的溶解度为 1:442 |
| C.99℃时水的离子积:1×10-12 |
| D.标准状况时氧气的密度:1.429 g/L |
氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
I.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式_____。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示)_______________。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。
写出上述化学反应方程式:_________________________。 II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
(4)下列能表明容器乙一定达平衡状态的是_____(填字母)
| A.容器内的混合气体的平均相对分子质量不再变化 | |
| B.容器内的氮元素的质量不再变化 | |
C.氢气的生成速率与氨气的消耗速率之比为2:3 |
D.形成1mol N N键的同时形成6molN—H键 |
(5)甲容器中氮气的转化率为_____。
(6)起始时,容器乙是容器甲压强的_____倍。