下列描述中正确的是( )
| A.CS2为V形分子 |
| B.NCl3的空间构型为平面三角形 |
| C.SF6中有4对完全相同的成键电子对 |
| D.SiF4和H2O的中心原子均为sp3杂化 |
NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,解释该事实的充分理由是
| A.NH3分子是极性分子 |
| B.分子内3个N—H键的键长相等,键角相等 |
| C.NH3分子内3个N—H键的键长相等,3个键角都等于107° |
| D.NH3分子内3个N—H键的键长相等,3个键角都等于120° |
下列现象与氢键有关的是
①HF的水溶液是弱酸,而其它卤族元素形成的氢化物水溶液是强酸
②乙醇可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
| A.②③④⑤ | B.②③⑤ | C.①②③④ | D.①②③④⑤ |
根据价层电子对互斥理论,判断下列分子或者离子的空间构型不是平面三角形的是( )
| A.SO3 | B.BF3 | C.CO32- | D.PH3 |
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
| A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B.Y分别与Z、W形成的化合物中化学键类型相同 |
| C.X的最高价氧化物对应水化物的酸性比W的弱 |
| D.Y的气态简单氢化物的热稳定性比W的强 |
下列有关σ键和π键的说法错误的是( )
| A.在某些分子中,化学键可能只有π键而没有σ键 |
| B.当原子形成分子时,首先形成σ键,可能形成π键,配位键都是σ键 |
| C.σ键的特征是轴对称,π键的特征是镜面对称 |
| D.含有π键的分子在反应时,π键是化学反应的积极参与者 |
“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,下列说法合理的是
A.N2O的电子式可表示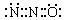 |
| B.N2O与SiO2为等电子体、具有相似的结构(包括电子式) |
| C.N2O与CO2均不含非极性键 |
| D.N2O为三角形分子 |
氰的分子式为(CN)2,结构式为N≡C-C≡N,性质与卤素相近,下列叙述正确的是
| A.在一定条件下可发生加成反应 |
| B.分子中N≡C键的键长大于C≡C键的键长 |
| C.分子中含有2个σ键和4个π键 |
| D.不和氢氧化钠溶液发生反应 |
下列说法错误的是( )
| A. |
糖类化合物也可称为碳水化合物 |
| B. |
维生素D可促进人体对钙的吸收 |
| C. |
蛋白质是仅由碳、氢、氧元素组成的物质 |
| D. |
硒是人体必需的微量元素,但不宜摄入过多 |
膦(PH3)又称为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,它的分子是三角锥形。以下关于PH3的叙述中,正确的是
| A.PH3是非极性分子 |
| B.PH3分子中有未成键的电子对 |
| C.PH3是强氧化剂 |
| D.PH3分子中的P—H键是非极性键 |
下列物质中含有共价键的离子化合物是
| A.HCl | B.NaOH | C.CaCl2 | D.N2 |
下列分子中所有原子都满足最外层8电子结构的是( )
①CO2 ②XeF6 ③PCl3 ④SO2 ⑤BF3 ⑥N2 ⑦P4 ⑧PCl5
| A.①③⑥⑦ | B.①④⑤ | C.①④⑥ | D.②③④⑤ |
化学式为N2H6SO4的某晶体,其晶体类型与硫酸铵相同,则N2H6SO4晶体中不存在
| A.离子键 | B.共价键 | C.分子间作用力 | D.阳离子 |