下列叙述正确的是
| A.离子化合物中只含有离子键 |
| B.共价化合物中一定不含离子键 |
| C.只含共价键的物质一定是共价化合物 |
| D.含有共价键的化合物一定是共价化合物 |
下列表达方式错误的是( )
A. |
B.甲烷的电子式 |
| C.硫离子的核外电子排布式 1s22s22p63s23p6 | D.碳-12原子构成  C C |
有下列几种物质:①HCl、②NH4Cl、③NaOH、④Cl2、⑤CO2、⑥H2O、⑦Na2O2。
(1)上述物质中,属于共价化合物的是 (填序号,下同),既存在离子键又存在极性键的是
(2)④号物质的电子式为 。
用电子式表示⑥号物质的形成过程:
下列说法正确的是
| A.124 g P4含有的P-P键的个数为6 NA |
| B.12 g石墨中含有的C-C键的个数为2 NA |
| C.12 g金刚石中含有的C-C键的个数为1.5 NA |
| D.60 g SiO2中含Si-O键的个数为2 NA |
用化学用语回答下列问题
(1)用电子式表示: Na2O2 ;
(2)用电子式表示Na2S的形成过程:
(3)用原子符号表示中子数为18的硫离子:
(4)空气中含量最多的气体单质分子的结构式 .
(5)氯化铵、次氯酸钠中均含有的化学键是
(6)原子序数为15的原子结构示意图: 、其最高价氧化物对应的水化物的化学式 、其气态氢化物的分子空间构型为 。
下列说法正确的是
| A.含极性键的分子一定是极性分子 |
| B.键能越小,表示该分子受热越难分解 |
| C.在分子中,两个成键原子间的距离叫做键长 |
| D.H-Cl的键能为431.8kJ/mol,H-I的键能为298.7kJ/mol,说明HCl分子比HI分子稳定 |
a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物。b为EDTA与Ca2+形成的螯合物。下列叙述正确的是( )

A.a和b中的N原子均为sp3杂化
B.b中Ca2+的配位数为4
C.b含有分子内氢键
D.b含有共价键、离子键和配位键
下列每组分子主要能形成分子间氢键的是( )
| A.HClO4 和 H2SO4 | B.CH3COOH和H2Se |
| C.C2H5OH和NaOH | D.H2O2和HNO3 |
氯化硼的熔点为-107℃、沸点为12.5℃,在氯化硼分子中,氯—硼—氯键角为120º,它可以水解,水解产物之一是氯化氢,下列对氯化硼的叙述中正确的是
| A.氯化硼是原子晶体 |
| B.熔化时,氯化硼能导电 |
| C.硼原子以sp3杂化 |
D.水解方程式:BCl3+3H2O H3BO3+3HCl H3BO3+3HCl |
下列有关硫元素及其化合物的表示正确的是
A.中子数为18的硫原子: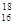 S S |
B.CS2分子的电子式: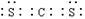 |
C.硫离子(S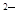 )的结构示意图: )的结构示意图: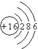 |
D.苯磺酸的结构简式: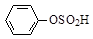 |
芥子气[(ClCH2CH2)2S是一种毒气,即使嗅觉不能感受的极低浓度也会对人造成伤害,可用NaOH溶液解毒。芥子气可用以下方法制备 2CH2=CH2+S2Cl2→(ClCH2CH2)2S+S下列有关说法正确的是
| A.芥子气是直线型分子 | B.S2Cl2中有极性键和非极性键 |
| C.制备反应中S2Cl2,作还原剂 | D.NaOH溶液解毒原理是中和反应 |