某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)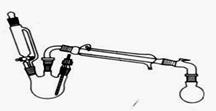
| |
密度g/mL |
熔点/℃ |
沸点/℃ |
水溶性 |
| 乙醇 |
0.79 |
-114 |
78 |
溶 |
| 乙酸 |
1.049 |
16.2 |
117 |
溶 |
| 乙酸乙酯 |
0.902 |
−84 |
76.5 |
不溶 |
合成反应:在三颈烧瓶中加入乙醇5mL,硫酸5mL,2小片碎瓷片。漏斗加入乙酸14.3 mL,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。分离提纯:将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)制取乙酸乙酯化学方程式为:_____________ _______。
(2)浓硫酸与乙醇如何混合? 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_______(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(5)蒸出的粗乙酸乙酯中主要有哪些杂质? 。
(6)饱和的Na2CO3溶液洗涤除去乙酸,能否换成NaOH溶液?若不能,为什么?(用化学方程式表示) ; 。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
Ⅰ:下图A为“人教版”教材制备乙酸乙酯的实验装置,某同学认为下图B装置进行酯化反应效果比A要好,他的理由是 。
Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:
| 实验步骤 |
实验现象 |
| ① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
镁浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 |
有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 |
剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 |
反应不十分剧烈;产生无色气体 |
| ⑤向A1Cl3溶液中滴加NaOH溶液至过量 |
生成白色胶状沉淀,继而沉淀消失 |
(2)由上述实验可得出的结论是:___________
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)甲同学的实验应该在___________中进行,才符合化学实验安全性的要求。
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式 ,所以他认为应该检验_____________(填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。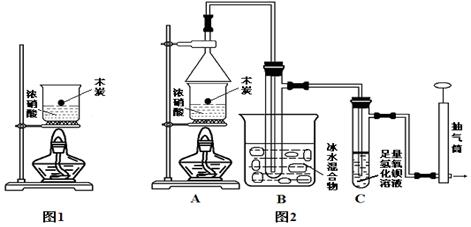
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是_________。
①将木炭与浓硝酸一同放在装置中加热;
②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;
④先加热浓硝酸,然后将木炭投入其中。
(4)请用平衡移动原理解释B装置的作用_____ _ ___(结合方程式与文字表述)。
(5)若同意碳与浓硝酸反应生成二氧化氮的观点。将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为: (列出计算表达式即可)。(忽略空气中二氧化碳的影响。相对原子质量:H 1 C 12 N 14 O 16 Ba 137)
(12分)某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2·6C2H5OH。请回答下列问题:
(1)制备乙酸乙酯装置如图所示,虚框内玻璃仪器名称为 ;冷凝水流经冷凝管时应从 口进入(填“a”或“b”);
(2)生成乙酸乙酯的化学反应方程式为 ;
(3)下列措施可提高乙酸的转化率可采取的有( )
A.增加乙醇的用量 B.蒸出乙酸乙酯
C.增加乙酸的用量 D.冷凝管中通热水
(4)实验所得乙酸乙酯远低于理论产量的可能原因 。(写出其中两种)
(5)为了除去粗产品其中的醋酸,可向产品中加入 溶液,在分液漏斗中充分振荡,然后静置,待分层后 (填选项)。
A.直接将有机层从分液漏斗上口倒出
B.直接将有机层从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将有机层从下口放出
D.先将水层从分液漏斗的下口放出,再将有机层从上口倒出
(6)再向得到的有机物粗产品中加入饱和氯化钙溶液,振荡、分离。加入饱和氯化钙溶液的目的是 。
(7)最后,加入干燥剂除去其中的水分,再进行 (填操作),即可得到纯净的乙酸乙酯。
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
已知:
| |
密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
| 环己醇 |
0.96 |
25 |
61 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
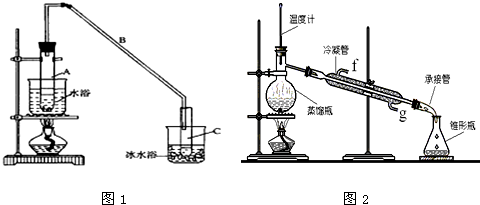
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在______层(填上或下),分液后用______(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2所示装置蒸馏,冷却水从______口进入。蒸馏时要加入生石灰,目的是 .
③收集产品时,控制的温度应在____左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是______.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
B.[实验化学]
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
| 化合物 |
相对分子质量 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100 g水 |
| 正丁醇 |
74 |
0.80 |
118.0 |
9 |
| 冰醋酸 |
60 |
1.045 |
118.1 |
互溶 |
| 乙酸正丁酯 |
116 |
0.882 |
126.1 |
0.7 |
请回答有关问题。
Ⅰ.乙酸正丁酯粗产品的制备在三颈圆底烧瓶中进行,并使用了分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。实验需要的药品:浓硫酸、冰醋酸和正丁醇。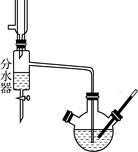
(1)有同学拟通过核磁共振氢谱鉴定所得产物中是否含有正丁醇,正丁醇的氢谱线中的几个峰的面积之比是________。
(2)反应前三颈圆底烧瓶中先加人适量沸石,然后依次加入________。
(3)分水器的作用________。
Ⅱ.乙酸正丁酯粗产品的精制。
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用________洗涤有机层,用分液法分离上述有机层和水层,分液完成后,取出有机层的操作是________。
(2)将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品。
Ⅲ.计算产率
如果实验中加入了18.5 mL正丁醇、15.4 mL冰醋酸和2 mL浓硫酸,实验后制得的乙酸正丁酯的质量为12.76 g,则乙酸正丁酯的产率为________。
化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
Ⅰ.下图A为“人教版”教材制备乙酸乙酯的实验装置,某同学甲认为下图B装置进行酯化反应效果比A要好,他的理由是_________________________;
某同学乙经查阅资料认为下图C装置进行酯化反应效果更好,他的理由是 ________________________。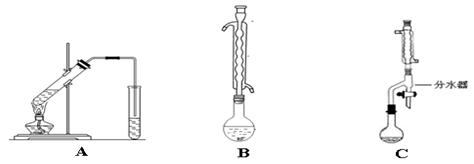
Ⅱ.某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)碳与浓硝酸反应的方程式_______________________。甲同学的实验应该在___________中进行,才符合化学实验安全性的要求。
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,所以他认为甲同学观点是错误的,他的理由是________________(用化学方程式表示),所以他认为应该检验_____________(填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。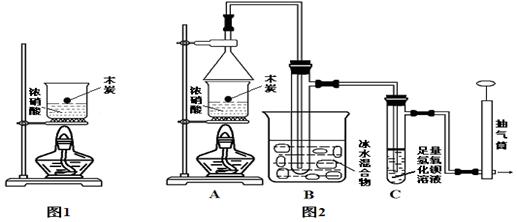
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)_________。
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸。③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中;
(4)请用平衡移动原理解释B装置的作用_________(结合方程式与文字表述)。
(5)C装置中出现的现象是_________,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式 ________________。
苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:
已知:
| 名称 |
相对分子质量 |
颜色,状态 |
沸点(℃) |
密度(g·cm-3) |
| 苯甲酸* |
122 |
无色片状晶体 |
249 |
1.2659 |
| 苯甲酸乙酯 |
150 |
无色澄清液体 |
212.6 |
1.05 |
| 乙醇 |
46 |
无色澄清液体 |
78.3 |
0.7893 |
| 环己烷 |
84 |
无色澄清液体 |
80.8 |
0.7318 |
*苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入12.20 g苯甲酸,25 mL 95%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。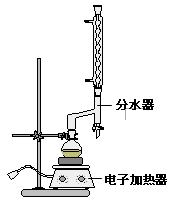
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是 (填入正确选项前的字母)。
A.25 mL B.50 mL C.100 mL D.250 mL
(2)步骤①中使用分水器不断分离除去水的目的是 。
(3)步骤②中应控制馏分的温度在 。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(4)步骤③加入Na2CO3的作用是 ;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是 。
(5)关于步骤③中的萃取分液操作叙述正确的是 。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为 。
(16分)某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2·6C2H5OH。
(1)制备乙酸乙酯装置如图所示,虚框内玻璃仪器名称为 ;

(2)生成乙酸乙酯的化学反应方程式为 ;浓硫酸的作用是 ;
(3)冷凝水流经冷凝管时应从 口进入(填“a”或“b”);
(4)下列措施可提高乙酸的转化率可采取的有( )
A.增加乙醇的用量 B.蒸出乙酸乙酯
C.增加乙酸的用量 D.冷凝管中通热水
(5)实验所得乙酸乙酯远低于理论产量的可能原因 。(写出其中两种)
(6)为了除去粗产品其中的醋酸,可向产品中加入 溶液,在分液漏斗中充分振荡, 然后静置,待分层后 (填选项)。
A.直接将有机层从分液漏斗上口倒出
B.直接将有机层从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将有机层从下口放出
D.先将水层从分液漏斗的下口放出,再将有机层从上口倒出
(7)再向得到的有机物粗产品中加入饱和氯化钙溶液,振荡、分离。加入饱和氯化钙溶液的目的是 。
(8)最后,加入干燥剂除去其中的水分,再进行 (填操作),即可得到纯净的乙酸乙酯。
水果成熟时,大多数香气袭人。乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成。有关物质的物理性质见右表。合成过程如下:第一步:将丁醇和x的混合液和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯。
| |
乙酸 |
1-丁醇 |
乙酸丁酯 |
| 熔点/℃ |
16.6 |
-89.5 |
-73.5 |
| 沸点/℃ |
117.9 |
117 |
126.3 |
| 密度/g·cm-3 |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
互溶 |
不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)C→F→ → → → 。
(2)C装置中除了装有1-丁醇和过量的乙酸外,还装有___________、_________。装置C中冷凝管的作用是: ;
(3)乙酸过量的原因是________________。
(4)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是_____ ___ _
(5)步骤E的操作要领是:①用一只手的手掌压住分液漏斗的塞子并握住分液漏斗;②另一只手握住活塞部分;③ 。
(6)要除去乙酸丁酯中含有的少量乙酸,下列试剂中可选用的是:
A. 饱和NaOH溶液 B. 饱和KHCO3溶液
C.饱和Na2CO3溶液 D. 饱和 K2CO3溶液
E. 饱和KOH溶液 F.过量的 1-丁醇
(16分)双安妥明是一种降血脂药物,主要用于降低血液中胆固醇浓度,安全,副作用小,其结构简式为:
已知:
双安妥明的合成路线如下:
已知:C的摩尔质量是同温同压下氢气质量的28倍;I能发生银镜反应且1mol I能与2molH2S生加成反应;K的结构具有对称性。试回答下列问题:
(1)双安妥明的分子式为:_____________。
(2)E的结构简式为:________________________
(3)反应②的条件是__________________
(4)J与新制氢氧化铜发生反应的化学方程式为:__________________
(5)反应④的化学方程式为:______________________________
(6)符合下列3个备件的H的同分异构体有____________种,①能与FeCl3溶液显色;②苹环上只有2个取代基:③1mol该物质最多可消耗3mol NaOH,其中氢原子共有五种不同环境的是(写结构筒式)____________