乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用下图A装置制备乙酸乙酯.
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:
与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是 .
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中试剂 |
有机层的厚度/cm |
| A |
2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 |
饱和Na2CO3溶液 |
3.0 |
| B |
2mL乙醇、1mL乙酸 |
0.1 |
|
| C |
2mL乙醇、1mL乙酸、 3mL 2mol•L-1H2SO4 |
0.6 |
|
| D |
2mL乙醇、1mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是 mL和 mol•L-1.
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为 .
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.图中( )内为适当的试剂,【 】内为适当的分离方法.
①试剂a是 ;分离方法②是 ,分离方法③是 .分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出
②在得到的A中加入无水碳酸钠粉末,振荡,目的是 .
(5)为充分利用反应物,甲、乙两位同学分别设计了上面图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是
提纯下列物质(括号内为少量杂质),所选用的除杂试剂与分离方法正确的是
| |
不纯物质 |
除杂试剂 |
分离方法 |
| A |
乙酸乙酯(乙酸) |
饱和碳酸钠溶液 |
过滤 |
| B |
乙烷(乙烯) |
酸性高锰酸钾溶液 |
洗气 |
| C |
苯(Br2) |
KOH溶液 |
分液 |
| D |
苯(苯酚) |
浓溴水 |
过滤 |
有机物A的化学式为C3H6O2,水解后得到一元酸M和一元醇N,已知M、N的相对分子质量相等,则下列叙述中,不正确的是( )
| A.N、M均不能发生银镜反应 | B.M中没有甲基 |
| C.M中含碳量为26.1% | D.N中含有甲基 |
某有机物的结构简式如图所示。1mol该有机物与足量的NaOH溶液共热,充分反应后最多可消耗NaOH的物质的量为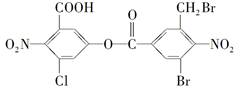
| A.2 mol | B.4 mol |
| C.6 mol | D.8 mol |
某有机物X能发生水解反应,水解产物为Y和Z。同温同压下,相同质量的Y和Z的蒸气所占体积相同,化合物X可能是
| A.乙酸丙酯 | B.甲酸甲酯 | C.乙酸甲酯 | D.乙酸乙酯 |
Ⅰ. 实验室制得气体中常含有杂质,影响其性质检验。
下图A为除杂装置,B为性质检验装置,完成下列表格:
| 序号 |
气体 |
反应原理 |
A中试剂 |
| ① |
乙烯 |
溴乙烷和NaOH的醇溶液加热 |
______________ |
| ② |
乙烯 |
无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是________________________ |
NaOH溶液 |
| ③ |
乙炔 |
电石与饱和食盐水反应 |
_______________ |
Ⅱ. 为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
| 试管编号 |
① |
② |
③ |
| 实验操作 |
 |
 |
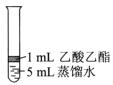 |
| 实验现象 |
酯层变薄 |
酯层消失 |
酯层基本不变 |
(1)试管①中反应的化学方程式是________________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是________________________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_______________________。
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有 ( )
| A.15种 | B.28种 | C.32种 | D.40种 |
用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,当反应达到平衡时,下列说法正确的是( )
| A.18O只存在于乙酸乙酯中 | B.18O存在于水、乙酸、乙醇以及乙酸乙酯中 |
| C.18O存在于乙酸乙酯、乙醇中 | D.若与丙酸反应生成酯的相对分子质量为102 |
乙酸橙花酯是一种食用香料,结构如图所示。下列关于该有机物的说法有如下几种: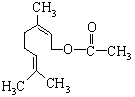
①该有机物有一种同分异构体属于酚类;②该有机物属于酯类;
③该有机物不能发生银镜反应;④该有机物的分子式为C11H18O2;
⑤1mol该有机物最多能与1mol NaOH反应。其中正确的是( )
| A.①③④ | B.②③⑤ | C.①④⑤ | D.①③⑤ |
)俗话说“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室,我们可以用下图所示的装置来制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学方程式 (3分)。
(2)浓硫酸的作用是 、 。
(3)饱和Na2CO3溶液的主要作用之一是能除去乙酸乙酯中的某种杂质,该反应的离子方程式为 。
(4)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是为了防止 。
(5)若要把制得的乙酸乙酯分离出来,应采取的实验操作是 。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全转化成生成物,反应一段时间后,就达到了该反应限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有 (填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
分科学家用Pb-磷化物催化二氧化碳和丁二烯发生化学反应,得到的主要产物甲的键线式如图所示,请回答下列问题:
(1)甲属于烃的衍生物中的 (填字母)。
| A.醇类 | B.酮类 | C.环酮 | D.环酯 |
(2)有机物甲的分子式为 。
(3)一定条件下,1 mol 甲发生加成反应所需要的H2的物质的量最多为 mol。
(4)该有机物分子中所有原子是否可能在同一个平面上? (填“可能”或“不可能”)。
关于实验室制备乙酸乙酯的说法中正确的是
| A.实验前,先向试管中加入2mL浓硫酸,然后再加入3mL乙醇和2mL乙酸 |
| B.收集乙酸乙酯的试管中应加入的试剂为饱和碳酸钠溶液 |
| C.实验中需加入碎瓷片作催化剂 |
| D.导管末端要插入液面以下 |
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式:
______________________________________________________________
(2)饱和碳酸钠溶液的主要作用是_____________________________________________。
(3)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_____________________。