下列变化中涉及化学变化的是( )
⑴爆竹燃放⑵碘的升华⑶金属钝化⑷铝热反应⑸干冰汽化⑹加热氯化铵⑺甘油加水作护肤剂⑻明矾净水⑼蜂蚁螫咬后涂稀氨水可以减痛⑽医用酒精可用于皮肤消毒⑾烹鱼时加入少量的料酒和食醋可减少腥味⑿橡胶老化⒀用四氯化碳可擦去圆珠笔油渍⒁蛋白质的盐析
| A.⑴⑶⑷⑸⑺⑿⒀ | B.⑵⑷⑸⑺⑿⒀⒁ |
| C.⑵⑸⑺⒀⒁ | D.以上选项均不正确 |
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是( )
A.反应②中的能量变化如图所示,则ΔH2=E1-E3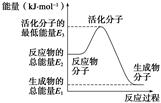 |
| B.H2的燃烧热为241.8 kJ·mol-1 |
| C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=+906 kJ·mol-1 |
下列关于四个图像的说法正确的是
A.图①表示化学反应中能量的变化,反应 的 的 |
| B.图②为氢氧燃料电池示意图,正、负极通入气体体积之比为2:1 |
C.图③表示压强对可逆反应 的影响,乙的压强大于甲 的影响,乙的压强大于甲 |
| D.图④表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯 |
已知甲、乙、丙、丁代表四种纯净物。甲(g)+2乙(g) 丙(g)+丁(g),△H=-akJ/mol(a>0) 下列说法正确的是( )
丙(g)+丁(g),△H=-akJ/mol(a>0) 下列说法正确的是( )
| A.甲的能量一定大于丙的能量 |
| B.该反应不需要加热 |
| C.1mol甲与2mol乙总能量高于1mol丙和1mol丁总能量 |
| D.该反应表示:1mol甲与2mol乙在一定条件下反应放出热量为akJ |
反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为 反应生成
反应生成 过程中的能量变化,下列说法正确的是
过程中的能量变化,下列说法正确的是
A.通常情况下, 混合能直接生成NO 混合能直接生成NO |
B.1mol 反应放出的能量为180kJ 反应放出的能量为180kJ |
| C.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
D.1mol 具有的总能量小于2mol 具有的总能量小于2mol  具有的总能量 具有的总能量 |
下列说法中正确的是
| A.干冰蒸发要吸收大量的热,这是化学反应中的吸热现象 |
| B.酒精常被用作酒精灯及内燃机的燃料,说明酒精燃烧是放热反应 |
| C.木炭常温下不燃烧,加热才能燃烧,说明木炭燃烧是吸热反应 |
| D.裂解的目的是为了提高汽油的产量 |
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S和无毒的气体。已知:
①CO(g)+ O2(g)=CO2(g)
O2(g)=CO2(g)  H=-283.0 kJ·mol-1
H=-283.0 kJ·mol-1
②S(g)+ O2(g)=SO2(g)  H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
下列说法正确的是
| A.CO的燃烧热为566.0 kJ·mol-1 |
B.反应② H<0,所以该反应能自发进行 H<0,所以该反应能自发进行 |
| C.使用催化剂能提高其转化率 |
| D.根据①和②推知总反应为2CO(g)+SO2(g)=S(s)+2CO2 (g) △H=-270kJ·mol-1 |
下列过程都与热量变化有关,其中表述不正确的是( )
| A.CO(g)的燃烧热是283.0KJ/mol,则表示CO(g)燃烧反应的热化学方程式为: CO(g)+1/2 O2(g)= CO2(g);△H=-283.0KJ/mol |
| B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3KJ/mol,则表示稀硫酸与稀氢氧化钡 溶液发生反应的热化学方程式为:H+ (aq) + OH-(aq) = H2O(l);△H=-57.3KJ/mol |
| C.铝热反应是放热反应,但需要足够的热量才能使反应发生 |
| D.水的电离过程是吸热过程,升高温度,水的离子积增大、PH减小 |
下列有关热化学方程式的叙述中,正确的是 ( )
| A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中[和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol |
B.已知热化学方程式:SO2(g)+ O2(g) O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ |
| C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| D.已知①S(s)+O2(g)=SO2(g); △H1②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2 |
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
| A.1/2N2H4(g)+1/2O2(g)=1/2N2(g)+H2O(g) ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH =-534 kJ·mol-1 |
| C.N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH =+534 kJ·mol-1 |
| D.N2H4(g)+O2(g)==N2(g)+2H2O(l) ΔH =-133.5 kJ·mol-1 |
下列关于能量转换的认识中不正确的是 ( )
| A.电解水生成氢气和氧气时,电能转化为化学能 |
| B.煤燃烧时,化学能主要转化为热能 |
| C.绿色植物进行光合作用时,太阳能转化为化学能 |
| D.白炽灯工作时,电能全部转化为光能 |
科学家发现,不管化学反应是一步完成还是分几步完成,该反应的热效应是相同的,已知在25℃、105Pa时,1molC(石墨)完全燃烧生成CO2气体,放热393.5kJ,1molCO完全燃烧生成CO2气体放热283.0kJ,下列说法正确的是 ( )
| A.在25℃、105Pa时,C(石墨)完全燃烧生成CO气体的热化学方程式为:2C(石墨)+ O2(g)=2CO(g);△H = -110.5kJ/mol |
| B.C(石墨)不完全燃烧生成CO和CO2混合气体时,放热283.0 kJ |
| C.C(石墨)和CO2(气)反应生成CO(气)的反应是吸热反应 |
| D.如果金刚石燃烧生成CO2的反应热大于石墨燃烧生成CO2的反应热,则可以断定从石墨变为金刚石的变化需要吸热 |
下图是N2与H2反应生成NH3的过程中能量变化的曲线图:下列叙述正确的是( )。
| A.该反应的热化学方程式为 N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
下列与化学反应能量变化相关的叙述正确的是 ( )。
| A.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| B.1 mol S完全燃烧放热297.3 kJ,其热化学方程式:S+O2=SO2 ΔH=-297.3 kJ·mol-1 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成1 mol BaSO4沉淀时放出的热量叫做中和热 |
| D.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
下列说法正确的是
| A.CO能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 |
| B.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| C.相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量 |
| D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |