下列说法正确的是
| A.甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g)△H=" -890.3" kJ/mol |
B.500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: |
C.已知:2CO(g)+O2(g) ===2CO2(g)ΔH=" -566" kJ/mol,下图可表示由CO生成CO2的反应过程和能量关系 |
| D.已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F 、S-F键需吸收的能量分别为160 kJ、330 kJ。已知1个 SF6(g)分子中含有6条S-F键。则:S(s)+3F2(g) ===SF6(g) △H=-1220 kJ/mol |
下列说法正确的是( )
| A.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| B.25 ℃、101 kPa时,1 mol S和2 mol S的燃烧热相等 |
| C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 |
| D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
下列依据热化学方程式得出的结论正确的是
| A.已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
下列对有关反应能量变化图像的判断错误的是( )
I Ⅱ Ⅲ Ⅳ
| A.I可表示需加热的放热反应 |
| B.Ⅱ可表示爆炸反应 |
| C.Ⅲ可表示无催化剂(a)和有催化剂(b)时反应的能量变化 |
| D.Ⅳ可表示醋酸和碱的中和反应 |
物质发生化学反应时,下列量值在反应前后肯定不发生变化的是 ( )
| A.物质的种类 | B.原子总数 |
| C.分子总数 | D.物质所具有的总能量 |
根据碘与氢气反应的热化学方程式
(i)I2(g)+ H2(g)  2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g)
2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g) 2HI(g) - 26.48 kJ
2HI(g) - 26.48 kJ
下列判断正确的是
| A.1mol I2(s)中通入2gH2(g),反应吸热26.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
| D.反应(i)放出的热量多,所以产物的能量低,比反应(ii)的产物更稳定 |
下列说法正确的是
A.已知: 则可以计算出反应 则可以计算出反应 的ΔH为-384 kJ/mol 的ΔH为-384 kJ/mol |
| B.辛烷的标准燃烧热为-5518 kJ/mol。则辛烷燃烧的热化学方程式可表示为: C8H18(g)+12.5O2(g)= 8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol |
C.2CO(g)+O2(g)=2CO2(g) ;ΔH=-566 kJ/mol 下图可表示该反应过程与能量的关系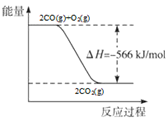 |
| D.S(s)+O2(g)=SO2(g);ΔH1 S(g)+O2(g)=SO2(g);ΔH 2则ΔH1>ΔH2 |
下列说法中,正确的是
| A.CO燃烧是放热反应 |
| B.升高温度,可以改变化学反应的反应热 |
| C.1 mol CH3COOH与1 mol NaOH完全中和,所放出的热量为中和热 |
| D.1 mol H2在足量Cl2中完全燃烧所放出的热量,是H2的燃烧热 |
下列说法正确的是
| A.在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol |
| B.在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为 —285.8kJ/mol |
| C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D.在稀溶液中:H+(aq) + OH--(aq) ="==" H2O(l);△H= —57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
| A.1molN2(g)和NA个O2(g)反应放出的能量为180kJ |
| B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:① S(单斜,s)+O2(g) ="=" SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) ="=" SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) ="=" S(正交,s) △H3
下列说法正确的是( )
| A.△H3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s) ="=" S(正交,s) △H3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s) ="=" S(正交,s) △H3>0,单斜硫比正交硫稳定 |
下列说法或表示方法正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
B.由C(石墨) C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 |
| C.1mol H2在足量Cl2中燃烧放热183KJ,则H2的燃烧热为183KJ。 |
| D.在稀溶液中,H+(aq)+OH-(aq)==H2O(l)ΔH="-57.3" kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,整个过程放出的热量大于57.3 kJ |
下列关于反应过程中能量变化的说法正确的是
| A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
| B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |
依据有关化学原理推断正确的是
| A.常温常压下,弱酸A的浓度小于弱酸B,则A的电离程度一定大于B |
| B.晶体A易溶于CCl4,则A一定是分子晶体 |
| C.在溶液中单质A能置换出金属B,则单质A可以是金属也可以是非金属 |
| D.能量越低越稳定,故自然界的物质都以能量最低的形态存在 |