[江苏]2013-2014学年江苏省扬州市高二上学期期末考试化学试卷(选修)
化学与生产和生活密切相关,下列说法正确的是
| A.聚氯乙烯塑料薄膜可用作食品保鲜膜、一次性食品袋等 |
| B.煤经过气化和液化等物理变化可转化为清洁燃料 |
| C.淀粉、油脂和蛋白质都是高分子化合物 |
| D.利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
下列有关化学用语表示正确的是
A.-CHO的电子式: |
B.丙烷分子的比例模型为: |
C.2-乙基-1,3-丁二烯的键线式: |
D.邻羟基苯甲酸的结构简式: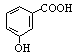 |
下列有机物命名正确的是
A.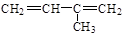 3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 |
B. 2-羟基丁烷 2-羟基丁烷 |
| C.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
| D.CH3CH(CH3)CH2COOH 3-甲基丁酸 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,22.4 L乙烯中C-H键数为4NA |
| B.1 mol甲醇中含有C-H键的数目为4NA |
| C.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| D.17 g羟基(-OH)所含有的电子数为7NA |
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
| A.复分解反应都是吸热反应 |
| B.NH4HCO3和盐酸的反应是吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 |
除去下列物质中的杂质(括号内的物质),所使用的试剂和主要操作都正确的是
| 选项 |
物质 |
使用的试剂 |
主要操作 |
| A |
乙醇(水) |
金属钠 |
蒸馏 |
| B |
乙酸乙酯(乙酸) |
饱和碳酸钠溶液 |
分液 |
| C |
苯(苯酚) |
浓溴水 |
过滤 |
| D |
乙烷(乙烯) |
酸性高锰酸钾溶液 |
洗气 |
下列有关工程塑料PBT(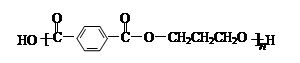 )的说法中,正
)的说法中,正
确的是
| A.PBT是加聚反应得到的高分子化合物 |
| B.PBT分子中含有羧基、羟基和酯基 |
| C.PBT的单体有一种是芳香烃 |
| D.PBT的单体均能与Na、NaOH、Na2CO3反应 |
下列依据相关实验得出的结论正确的是
| A.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 |
| B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| C.只用溴水就可以将苯、四氯化碳、酒精、已烯、苯酚这五种物质区别开 |
| D.淀粉用酸催化水解后的溶液加入新制银氨溶液水浴加热可看到有银镜出现 |
“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e- = X + 2H+。下列说法中正确的是
| A.电池内部H+由正极向负极移动 |
| B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH- |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
下列离子方程式正确的是
| A.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
B.甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH- HCOO-+NH4++2Ag↓+3NH3+H2O HCOO-+NH4++2Ag↓+3NH3+H2O |
C.乙醛与碱性氢氧化铜悬浊液混合后加热至沸腾:CH3CHO+2Cu(OH)2+OH— Cu2O↓+CH3COO—+3H2O Cu2O↓+CH3COO—+3H2O |
| D.向小苏打溶液中加入醋酸: CO32-+2CH3COOH =CO2↑+H2O+2CH3COO- |
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间。假设在电解过程中产生的气体全部逸出,下列说法正确的是
| A.甲、乙两烧杯中溶液的pH均保持不变 |
| B.甲烧杯中a电极反应式为:4OH――4e-=O2↑+2H2O |
| C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 |
| D.当b极增重3.2 g时,d极产生的气体为0.56 L(标准状况) |
下列说法正确的是
A.已知: 则可以计算出反应 则可以计算出反应 的ΔH为-384 kJ/mol 的ΔH为-384 kJ/mol |
| B.辛烷的标准燃烧热为-5518 kJ/mol。则辛烷燃烧的热化学方程式可表示为: C8H18(g)+12.5O2(g)= 8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol |
C.2CO(g)+O2(g)=2CO2(g) ;ΔH=-566 kJ/mol 下图可表示该反应过程与能量的关系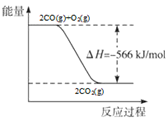 |
| D.S(s)+O2(g)=SO2(g);ΔH1 S(g)+O2(g)=SO2(g);ΔH 2则ΔH1>ΔH2 |
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
下列有关叙述正确的是
| A.贝诺酯分子中有三种含氧官能团 |
| B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C.乙酰水杨酸和对乙酰氨基酚均能与Na2CO3溶液反应 |
| D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚 |
下列实验装置图合理的是 



① ② ③ ④
| A.装置①可用于证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 |
| B.装置②能构成锌铜原电池 |
| C.装置③可用于粗铜的电解精炼 |
| D.装置④可用于在实验室测定中和反应的反应热 |
当两种有机物总质量一定时,以任意比例混合后,充分燃烧,所得的CO2和H2O的物质的量总是相等的是
| A.乙醇、乙醚 | B.乙烯、丁烯 | C.苯、苯酚 | D.甲烷、甲醇 |
药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4
-环己二酮单乙二醇缩酮)为原料合成(如下图)。
试填空:
(1)X的分子式为 ;该分子中最多共面的碳原子数为 。
(2)Y中是否含有手性碳原子 (填“是”或“否”)。
(3)Z能发生 反应。(填序号)
A.取代反应 B.消去反应 C.加成反应
(4)1 mol Z与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠 mol;
1 mol Z在一定条件下与足量H2充分反应,需要消耗H2 mol。
(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
| |
苯 |
溴 |
溴苯 |
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
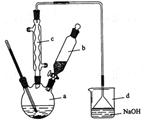
按以下合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液溴。向a中滴入几滴液溴,有白雾产生,是因为生成了 气体。继续滴加至液溴滴完。装置d中NaOH溶液的作用是 。
(2)反应过程中,a外壁温度升高,为提高原料利用率,利用温度计控制温度,适宜的温度范围为(填序号) 。
A.>156℃ B. 59℃-80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是 ;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是 。
(4)经过上述分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。且B的核磁共振氢谱显示有3组不同的峰。
(1)A的分子式是 。
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是(填序号) 。
A.C5H12O3 B.C4H10 C.C6H10O4 D.C5H10O
(3)①B的结构简式是 。
②A不能发生的反应是(填序号) 。
A.取代反应 B.消去反应 C.酯化反应 D.还原反应
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,该异构体的结构简式是: 。
由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
(1)聚合物F的结构简式 。A→B的反应条件为 。E→G的反应类型为 。
(2)D的结构简式 。B转化为C的化学反应方程式是 。
(3)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是 。
(4)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol H2,则该种同分异构体的结构简式为 。
为减小和消除过量CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
写出分解池中反应的化学方程式 。在合成塔中,当有4.4 kg CO2与足量H2
完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式 。
(2)以CO2为碳还可以制备乙醇,反应如下:
2CO2(g) + 6H2(g)= CH3CH2OH(g) + 3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。当电子转移 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)以甲醇为燃料还可制作新型燃料电池,电池的正极通入O2,负极通入甲醇,用熔融金属氧化物MO作电解质(可传导O2-)。该电池负极发生的电极反应是 ;放电时,O2-移向电池的 (填“正”或“负”)极。
慢心律是一种治疗心律失常的药物,它的合成路线如下:
(1)由B→C的反应类型为 。
(2)C分子中有2个含氧官能团,分别为 和 (填官能团名称)。
(3)写出A与浓溴水反应的化学方程式 。
(4)由A制备B的过程中有少量副产物E,它与B互为同分异构体,E的结构简式为 。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式 。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子。
(6)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷( )。写出以邻甲基苯酚(
)。写出以邻甲基苯酚( 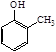 )和乙醇为原料制备
)和乙醇为原料制备  的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下: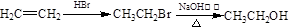
 粤公网安备 44130202000953号
粤公网安备 44130202000953号