反应:2H2(g)+O2(g)===2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是( )
| A.ΔH1<0 | B.ΔH2为该反应的反应热 |
| C.ΔH3不是H2的燃烧热 | D.ΔH2=ΔH1+ΔH3 |
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 |
| B.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C.已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ |
| D.已知2C(s)+2O2(g)=2CO2(g)△H1 |
2C(s)+O2(g)=2CO(g)△H2则△H1<△H2
把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
请回答下列问题:
(1) 途径I放出的热量 ( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2) △H1、△H2、△H3、△H4的数学关系式是 。
(3)12g炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为 。
(4)煤炭作为燃料采用途径II的优点有
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g)=2CO2(g) △H3<0 ③
2H2(g)+O2 (g)=2H2O(g) △H4<0 ④
请回答下列问题:
(1)途径I放出的热量 ( 填“大于”“等于”或“小于”) 途径II放出的热量,原因是 。
(2)△H1、△H2、△H3、△H4的数学关系式是 。
(3)12g炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为 。
(4)煤炭作为燃料采用途径II的优点有
下列热化学方程式正确的是(注: 的绝对值均正确)( )
的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq) + HCl(aq)="NaCl(aq)" + H2O(l);△H= —57.3kJ/mol(中和热) |
| C.S(s) + O2(g) = SO2(g);△H= —269.8kJ/mol(反应热) |
| D.2HCl(g)=Cl2(g) + H2(g);△H=" —" 184.6kJ/mol(反应热) |
下列关于热化学反应的描述中正确的是( )
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |
| B.吸热反应一定需要加热才能发生 |
| C.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| D.CO燃烧热为283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)的ΔH=+566.0 kJ·mol-1 |
拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) 2NH3(g) ΔH=-92.4 kJ /mol,下列说法中正确的是
2NH3(g) ΔH=-92.4 kJ /mol,下列说法中正确的是
| A.H-H比N≡N更牢固 |
| B.N≡N键能约为946 kJ/mol |
| C.合成氨反应选择适当的催化剂是为了提高H2的转化率 |
| D.0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ |
下列有关热化学方程式的叙述正确的是
| A.已知2H2(g)+O2(g)= 2H2O(l) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为285.8 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)= CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
已知:C(s,石墨) ="=" C(s,金刚石) ΔH =" +1.9" kJ·mol-1。下列有关说法正确的是
| A.相同条件下,1 mol石墨比1 mol金刚石能量高 |
| B.断裂1mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少 |
| C.若:C(s,石墨) + O2(g)==CO2(g) ΔH1=-393.5 kJ•mol-1 则有:C(s,金刚石) + O2(g)==CO2(g)ΔH2=-395.4 kJ·mol-1 |
| D.其他条件不变时,加入合适的催化剂,可实现该反应的反应热转变为ΔH<0 |
碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
① H2(g)+I2(?) 2HI(g)+9.48kJ② H2(g)+I2(?)
2HI(g)+9.48kJ② H2(g)+I2(?) 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
| A.①中的I2为固态,②中的I2为气态 |
| B.②的反应物总能量比①的反应物总能量低 |
| C.①的产物比反应②的产物热稳定性更好 |
| D.1mol 固态碘升华时将吸热17kJ |
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。
已知:CH3OH(l)+O2(g)= CO(g)+2H2O(g) 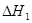 ="-443.64" kJ·mol-1
="-443.64" kJ·mol-1
2CO(g)+ O2(g)= 2CO2(g) 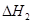 = -566.0kJ·mol-1
= -566.0kJ·mol-1
下列说法或热化学方程式正确的是
| A.CO的燃烧热为566.0 kJ·mol-1 |
| B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 |
| C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ |
D.2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)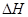 ="-1453.28" kJ·mol-1 ="-1453.28" kJ·mol-1 |
下列有关热化学方程式的叙述正确的是( )
| A.已知2H2(g)+O2(g)= 2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B.已知C(石墨,s)= C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g) ;△H2。则△H1<△H2 |
下列说法或表示方法正确的是( )
| A.已知C(s)+O2(g)=CO2(g) ΔH1,C(s)+1/2O2(g)="CO(g)" ΔH2;则ΔH1>ΔH2 |
| B.等量的H2在O2中完全燃烧,生成气态水比生成液态水放出的热量多 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同 |
| D.由石墨比金刚石稳定可知:C(金刚石, s)=C(石墨, s) ΔH >0 |