(12分)如图所示,已知:


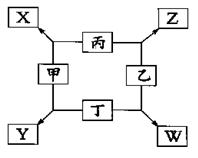
①甲、乙、丙均为前三周期元素的气体单质,丁为固体单质。
②在一定条件下甲与丙、甲与丁都按微粒个数比l:3组成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙、乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:


(1)甲是_______________________,乙是_______________________。
(2)写出X、Y的电子式
________________________________________、_________________________________。
(3)乙与丁反应生成W的化学方程式是
________________________________________________________________。
(4)甲与丙反应生成X的化学方程式是
________________________________________________________________。
(5)实验室制取X的化学方程式是
________________________________________________________________。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:甲: 、乙: 、F: 、H 、
(2)金属B既能与强酸又能与强碱反应,该金属B是: (填化学式)
金属C的最高价阳离子遇KSCN溶液呈血红色,该金属C是: (填化学式)
(3)反应③的化学方程式 。
(4)反应⑤的离子方程式 。
某非金属单质A经如下图所示的过程转化为含氧酸D, ;已知D为强酸,请回答:
;已知D为强酸,请回答:
(1)若A常温下为 淡黄色固体,B是有刺激性气味的无色气体。
淡黄色固体,B是有刺激性气味的无色气体。
①画出A的原子结构示意图_______________________
②把B通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀化学式为:
③D的浓溶液在加热的条件下可与Cu反应,该反应的化学方程式为:
(2)若A在常温下为气体,C是红棕色气体。
①写出A单质的电子式 。
②C→D的反应中氧化剂与还原剂物质的量之比为:
③写出A与H2反应产物的结构式:
A、B、C、X均为中学常见的物质,它们之间有如下转化关系(其它产物已略去):
则下列说法不正确的是
A.若A是NH3,则C可能是氧化物
B.若A是非金属单质,则C与水反应的生成物一定是强酸
C.若X是金属单质,则B、C中X的化合价可能是B>C
D.若X是强碱,则B可能是两性物质
下图是六种物质的相互转化关系,已知E是固体单质,六种物质均含有E元素。

(1)写出各物质的化学式: B ;E ;F ;
(2)写出反应①的离子方程式________________________________________
(3)写出反应④的化学方程式_________________________________________
(4)写出B→C反应的化学方程式
(13分) 下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
(已知:2Al + 3FeO 3Fe + Al2O3;2
3Fe + Al2O3;2 Al + Fe2O3
Al + Fe2O3 2Fe + Al2O3;
2Fe + Al2O3;
8Al + 3Fe3O4 9Fe + 4Al2O3)
9Fe + 4Al2O3)
(1)化合物A的化学式是 ,写出物质A的一种用途 。
(2)写出单质B与强碱溶液反应的离子方程式 。
(3)写出由沉淀J生成 H溶液的离子方程式  。
。
(4)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式 。
白色沉淀L会迅速变为 色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式 。
色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式 。
(5)溶液I中所含金属离子是_____________________。
室温下,单质A为日常生活中使用最广泛的金属;单质B为黄绿色气体,单质C为常温常压下密度最小的无色气体。在合适的条件下,它们可以按如图所示进行反应,又知D溶液为黄色,E溶液为无色。
(1)写出下列物质的化学式:
D________________ ; E _________________ ; F ____________________ 。
(2) 写出F溶液在空气中与氢氧化钠溶液反应的化学方程式:____________________。
下图为一些常见物质的转化关系图(部分反应物与生成物未标出)。A、C、E、G为单质,其中A、C、G为金属,E为气体。B为常见无色液体,L为红褐色固体,I的焰色反应呈紫色。常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质。
⑴A在元素周期表中的位置为 ▲ ,H的电子式为 ▲ 。
⑵写出有关反应的离子方程式:
反应①的离子方程式为 ▲ 。
反应②的离子方程式为 ▲ 。
⑶反应③中每生成1 mol E,转移电子的物质的量为 ▲ 。
A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气态,其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合,有关的转化关系如下图所示(反应条件均已略去)回答下列问题:
⑴Z分子的空间构型为
⑵反应③中被氧化的物质与被还原的物质的物质的量之比为 。
⑶Z和W在催化剂作用下,反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的方程式为 。
⑷将过量的E加到N的稀溶液中,若过程中转化的电子数目为3.02×1023个,则参加反应的E的物质的量为 mol。
⑸将Z和N反应后的产物溶于水中,则溶液的pH值(填“<”或“>”) 7,其原因是(用离子方程式表示) 。
甲、乙、丙是三种常见的单质,X、Y、Z是它们的化合物,它们之间有如下图所示的转化关系:
(1)若甲是具有还原性的金属单质,X、Y、Z中有一种是离子晶体,试推断:
①X、Y、Z中含有丙元素的是 ;
②写出Y的电子式 ;
③写出X与甲反应的化学方程式,并标出电子转移的方向和数目:
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是暗红色的液体,Y和Z
具有相同的阳离子,X与Z含有相同的离子。
①写出乙物质的化学试 ;
②写出X与足量的甲在溶液中完全反应的离子方程式:
过氧化尿素[CO(NH2)2·H2O2 ]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域。其合成如下:
试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,并控制合成温度在25—30℃,其主要原因是___________________________________。
(2)从母液中分离出H2O2和尿素,采用的操作是___________。
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000 mol/L KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应)。
①KMnO4溶液应盛放在________式(选填:“酸”、“碱”)滴定管中。
②完成并配平方程式:__MnO4-+ ___H2O2+___H+=___Mn2++ ____H2O+___ _____
③根据滴定结果,可确定产品中活性氧的质量分数为:___________。
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量______(选填:“偏高”、“偏低”或“不变”)。
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为_________。
(10分)有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的元素已经略去。
(1)若A与NaOH按不同物质的量比反应,既可只生成B,又可只生成C,还可生成B+C。
①写出符合上述反应关系的A的化学式 。
②写出上述有关反应的离子方程式:
生成B的离子方程式为 。
生成C的离子方程式为 。
(2)若A与NaOH无论以何种物质的量比反应,其产物必为B+C,则A的分子式可能是
(只写一种),该反应的离子方程式为 。
R在A、B、C中的化合价必须满足的条件是 。
甲、乙、丙、丁分别是Al2(SO4)3、FeCl2、NaOH、BaCl2四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生。据此可推断丙物质是
| A.Al2(SO4)3 | B.NaOH | C.BaCl2 | D.FeCl2 |
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
⑴D的化学式为 ▲ ;F的电子式为 ▲ 。
⑵A与B生成D的反应在工业上是生产 ▲ 的反应原理之一。
⑶E与G的稀溶液反应的离子方程式为 ▲ 。
⑷B和C反应的化学方程式为 ▲ 。
⑸J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式 ▲ 。