(15分)下列关系图中,A是一种酸式盐,D的分子式比C的大16,E是酸,当X无论是强酸或强碱都有如下反应关系:
当X是强酸时,A、B、C、D、E均含同一元素;
当X是强碱时,A、B、C、D、E均含另一元素。
回答下列问题(用化学式)
(1)A是_______,Y是_______ ,Z是_______
(2)当X是强酸时,B是__________,E是_________。
(3)当X是强碱时,B是__________,E是_________。
(4)写出A与X反应的离子方程式:
①__________________________。(X是强酸时)
②____________________________。(X是强碱时),在实验室制取B的化学方程式是____________,检验该物质的方法是________,收集方法的___________。
D、E为中学化学常见的金属单质,F是一种黑色晶体。E与C的浓溶液在常温作用无明显现象,加热时则有大量无色气体产生,同时生成H。在一定条件下C、D间能发生反应。各物质转化关系如下图:
(1)已知1g E在B中燃烧放出的热量为Q kJ,试写出表示E燃烧热的热化学方程式______。
(2)检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________。
A.氯水和KSCN溶液 B.氢氧化钠溶液 C.酸性KMnO4溶液
(3)用惰性电极电解一定浓度的A的水溶液,阳极反应式为_____________________,通电一段时间后,向所得溶液中加入8.0g D的氧化物后恰好恢复到电解前的浓度和pH,则电解过程中收集到标准状况下的气体体积为__________。
(4)假设用以铂做电极,KOH溶液为电解质溶液的肼(N2H4)——空气燃料电池作为本过程的电源,则放电时的负极反应式 (生成物均无污染)。
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。请根据以上信息回答下列问题: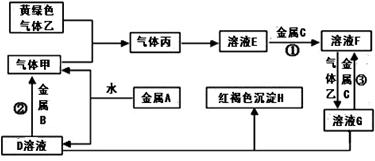
(1)写出下列物质的化学式:乙 、H ;
(2)写出反应②的离子方程式: ;
(3)写出金属A与水反应的离子方程式 ;
(4)F与D溶液反应后的产物在空气中转化为H的化学方程式 ;现象为 。
在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)
(1)若A为金属单质,B、C为常温下气态非金属单质,D为黑色晶体,A和E在一定条件下反应生成D的化学方程式为 .
(2)若A为金属单质,B、C为非金属单质,C为黑色固体,A和E在一定条件下反应生成D的化学方程式为 .
(3)若A为非金属单质,B为金属单质,C为D的水溶液,图示中所有反应均为化合反应,A和E在水溶液中反应生成D的离子方程式为____________________________,B和C在水溶液中反应生成E的离子方程式为_______________________________________。
A是一种红棕色金属氧化物,B、D是常见金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。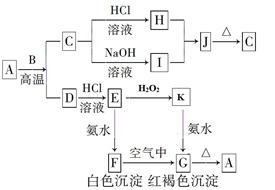
按要求写方程式:
(1)A与B在高温条件下生成C和D的化学方程式:_________________________
(2)F在空气中转化为G的化学方程式:___________________________________
(3)C转化为I的离子方程式:_______________________________________
(4)E转化为K的离子方程式:______________________________________
(13分)下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。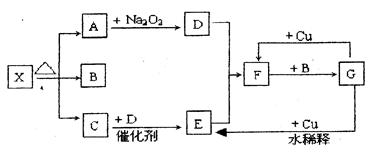
(1)写出下列各物质的化学式:
X: ;B: ;F: ;G: 。
(2)写出下列变化的反应方程式:
A→D: ;G→E: 。
(3)实验室里,常用加热 的混合物的方法制取气体C,常采用 法来收集,可否用无水CaCl2干燥气体C (填“否”或者“可以”)。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A 、 B 、 C 、乙
(2)写出下列反应化学方程式:
反应①
反应③
(3)写出下列反应离子方程式:
反应④
反应⑥
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、D所含物质的化学式
固体B ;沉淀D 。
(3)写出①、②反应的离子方程式:
① ;② ;
(4)以Fe2O3为原料,可制备FeCl2溶液,请写出有关的化学反应方程式,试剂任选。
已知物质A~I之间的转化关系符合下图所示。其中A、C、F、G、I为常见固体且其焰色反应均为黄色;A为海水中主要溶质,B为常温下常见液体;E为黄绿色气体,H能使澄清石灰水变浑浊,其余物质通常状况下均为气体。


试回答下列问题:
(1)写出下列物质的化学式:A E F H
(2)完成反应②离子方程式:
反应③化学方程式:
Ⅰ.已知A是一种金属,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟。A、B、C、D、E、F间有如下变化关系:
(1)B→D反应的化学方程式为 。
(2)F在空气中遇水蒸气产生白雾现象,这白雾实际上是 。
Ⅱ.已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。
试回答:
(1)写出下列物质的化学式Y________、C________。
(2)反应①的离子方程式为____________,反应②的离子方程式为_______________。
已知:(1)A为正盐。(2)常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,H为黄绿色气体,I通常为红棕色气体。(3)F在常温下是一种无色液体。(4)C、J的水溶液是一种酸。图中部分反应条件及产物已略去。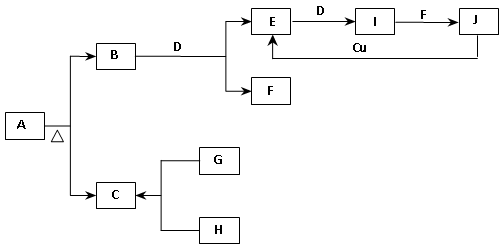
(1)写出A的化学式:A 。
(2)写出下列反应的化学方程式:
①B + D → E + F : ;
②J + Cu → E: ;
③H和石灰乳的反应: 。
(3)在I和F的反应中,氧化剂和还原剂的质量比为: 。
物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D为单质,试回答问题。
(1)写出下列物质的化学式:
A是__________,D是__________,K是__________。
(2)写出反应“C→F”的离子方程式:__________________________。
(3)写出反应“F→G”的化学方程式:_____________________________。
(4)在溶液I中滴入NaOH溶液,可观察到先生成白色絮状沉淀,而后迅速变为灰绿色,最后变为红褐色沉淀,请写出白色絮状沉淀变为红褐色沉淀的化学方程式__________________。
(5)请写出实验室制备黄绿色气体E的化学方程式:_____________________。
(6)溶液I中通入气体E发生的离子方程式为:_________________________。
字母A—F代表六种不同物质,它们之间可发生如下图的转化(部分反应中生成物没有全部列出)。其中D是一种强酸;E是一种常见金属,有“国防金属”的美誉,可在CO2中燃烧。分析图示回答下列问题:
(1)A可以是 或 ;
(2)E在CO2中燃烧的化学方程式为 ;
(3)D与F反应的化学方程式为 ,该反应中D表现了 性;
(4)50mL 14 mol·L-1物质D的溶液中加入足量的铜,充分反应后共收集到气体2.24L(标准状况下),则被还原的D的物质的量为 mol,参加反应的铜的质量为 g。
(6分)下图是中学化学中常见的一些物质之间的转化关系图,其中部分反应中的产物未列出。已知:A为红色固体,B为无色油状液体,是实验室常见的气体干燥剂, C是无色气体,F为黄绿色气体,G为白色沉淀。
(1)G的化学式为 。
(2)F的电子式为 。
(3)写出H与稀硫酸反应生成D溶液的离子方程式 。
(4)写出无色气体C与O2反应生成I的化学方程式,并用双线桥表示出电子转移的方向和数目: 。
A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末, C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。回答下列问题:
(1)B中阴离子的电子式为 ,与E组成元素相同的化合物的结构式为 。
(2)已知D与G反应生成ImolE放出的热量为aKJ,请写出表示D与H2SO4中和热的热化学方程式 。
(3)向FeCl2溶液中加入大量固体B,写出反应离子方程式 。
(4)常温下以Pt为电极电解滴加有少量酚酞的H饱和溶液2L,则在 (填“阴或阳”)极附近溶液由无色变为红色,若用F、C组成电池(熔融K2CO3做电解质)供电,电池的负极反应式为 ,正极反应式为 ,电解过程中,忽略溶液体积变化,则当溶液的PH=13时,负极消耗气体的体积在标况下为 。