下列框图中,已知A、E、F、H是单质,其中只有A是固体,其它都是气体,且H是呈黄绿色;B是最常见液体,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。
(1)写出H的化学式: 、C的电子式: 。
(2)写出D与I溶液发生反应的离子方程式: 。
(3)写出L→M的化学方程式: 。
(4)检验J中的阳离子时,不宜选用下列试剂中的 (填选项字母)。
A.Fe粉 B.NaOH溶液 C.KSCN溶液
甲、乙、丙、丁四种物质之间具有如右转化关系: 。
。
请回答下列问题:
(1)若乙为两性不溶物,则丙转化为乙的离子方程式为 ;
(2)若丙为形成酸雨的主要物质,则甲的化学式 ,乙能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式为 ;
(3)若丙中含有目前人类使用最广泛的金属元素,且乙转化成丙为化合反应,则将丙溶液蒸发、灼烧得到的物质是 ,除去丙溶液中少量乙的方法是 (用化学方程式表示),如何检验乙溶液中的丙,请设计实验方案 。
下图转化中的字母只代表一种单质或化合物,A是淡黄色固体,B为金属单质,J是白色胶状沉淀,常温下X是液体,C、D、Y均为气体。请回答下列问题:
(1)写出化学式: B X
(2)A中存在的化学键类型 H的俗名 Y的电子式
(3)写出下列方程式
反应①的化学方程式
反应②的离子方程式
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(水及部分产物已略去)。
(1)若X为金属单质,W是某强酸的稀溶液。X与少量W反应生成Z的离子方程式为 ,向Y溶液中加入某种试剂 (填试剂名称),若溶液出现血红色,即可判断Y溶液中阳离子的存在。
(2)若X、Y为正盐,X的水溶液显酸性,W为NaOH溶液,写出Y与X在水溶液中转化为Z的离子反应方程式 。
(3)若X为强碱,常温下W为有刺激性气味的气态氧化物。常温时,将Z的水溶液露置于空气中,溶液的PH变化是 (填“变大”、“变小”、“不变”。不考虑水的挥发),其原因是_________ (用简要的文字说明,并写出离子方程式)。
(4)室温下,若用 的NaOH溶液滴定
的NaOH溶液滴定 mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
已知M和R是两种常见的金属单质,其中M为红色。它们在一定条件下有如下转化关系,Q溶液呈红色。
请根据上述框图回答有关问题:
(1)上述转化关系中,属于非氧化还原反应的是 (填序号)。
(2)分别写出③、⑥对应的离子方程式 、 。
(3)K2RO4是一种新型绿色净水剂,请写出该净水剂的净水原理: 。
A~G各物质间的关系如下图,其中B、D为常见的气态单质。
请回答下列问题:
(1)物质C和E的名称分别为________________、__________________;
(2)可选用不同的A进行反应①(MnO2为催化剂),若能在常温下进行,其化学方程式为____________ _;
若只能在加热情况下进行,则反应物A应为______ (填化学式);
(3)反应E和C的化学方程式为_______________________________________;
(4)新配制的F溶液应加入___________以防止其转化为G。检验G溶液中阳离子的常用
试剂是_____________,实验现象为________________________________________。
根据下图所示的转化关系回答问题。
(1)写出下列物质的化学式
E F G X
(2)写出下列反应的离子方程式
A+B→ ;
C+D→ ;
F+G→ ;
D+AgNO3→ 。
已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
(1)写出下列各物质的官能团的名称:
A ___________;F ___________;G___________。
(2)按要求写出下列各步变化的化学方程式(注明反应条件)
反应①_____________________________________________________;
反应④_____________________________________________________;
反应⑦ _____________________________________________________。
(3)写出下列反应类型:
反应① ___________,反应②___________,反应④___________,反应⑦___________。
图所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图
所示。
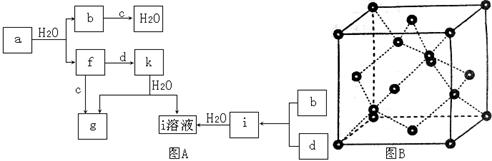
回答下列问题:
(1)图对应的物质名称是,其晶胞中的原子数为,晶体类型为。
(2)d中元素的原子核外电子排布式为。
(3)图中由二种元素组成的物质中,沸点最高的是,原因是,该物质的分子构型为,中心原子的杂化轨道类型为。
(4)图中的双原子分子中,极性最大的分子是。
(5)k的分子式为,中心原子的杂化轨道类型为,属于分子(填"极性"或"非极性")。
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,右图是它们之间的相互转化关系。请回答: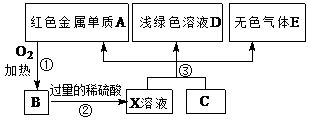
(1)反应①的基本反应类型是 ;
(2)C的化学式为 ;
(3)写出反应②的离子方程式 。
(4)A和稀硫酸、双氧水生成X的化学方程式 。
已知常温下A是黄绿色气体,C是淡黄色固体,E为红褐色胶体。在合适的反应条 件下,他们可以按下图进行反应: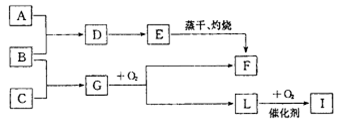
(1) 上图F物质的化学式________
(2) 简要写出由D制备E胶体的实验操作过程_______。
(3) 写出B+ C→G在一定条件下发生的化学反应方程式_______
(4) 写出B在潮湿的空气中发生电化学腐蚀时,正极的电极反应式:_______
(5) 在一定温度下, 。向一个容积不变的 容器中,充入2mol L和1molO2,使之充分反应,放出的热量为Q,则Q_______196. 6kJ (填“ >”、“〈”或“=”)。
。向一个容积不变的 容器中,充入2mol L和1molO2,使之充分反应,放出的热量为Q,则Q_______196. 6kJ (填“ >”、“〈”或“=”)。
A、B、C、D为常见气体单质。已知:
①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体;
②C分别与A、B反应生成的两种化合物分子中都含有10个电子。
③C和D反应生成的化合物易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀。
请回答:
(1)C和D反应生成的化合物的电子式是 。
(2)上述②中化合物的热稳定性 强于 。(填写化学式)
(3)将D通入B、C生成的化合物中,发生反应的化学方程式为 。
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。
请回答下列问题:
(1)B中所含元素位于周期表中第 周期 族。
(2)电解X溶液的离子方程式: 。
(3)D + E → B的反应中,被氧化与被还原的物质的物质的量之比是 。
(4)G + J → M的离子方程式是 。
(5)Y受热分解的化学方程式是 。
下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。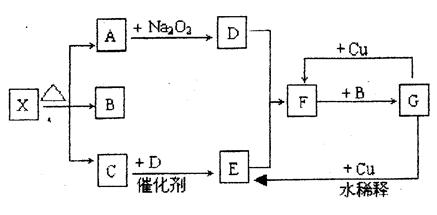
(1)写出下列各物质的化学式:
X: ;B: ;F: ;G: 。
(2)写出下列变化的反应方程式:
A→D: ;
G→E: 。
(3)实验室里,常用加热 的混合物的方法制取气体C,常采用 法来收集。
已知A、B、C、D、E为中学化学中常见的化合物,其中A是淡黄色固体,B是无色液体,甲、乙、丙为非金属单质,丁为地壳中含量最多的金属元素所组成的单质,C的焰色反应呈黄色,丙是黄绿色气体,它们之间的转化关系如图所示(有的反应部分产物已经略去):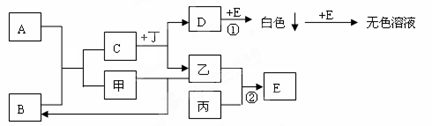
(1)实验室制取丙的化学方程式为 ,描述反应②的反应条件及现象
(2)反应①的化学方程式为:
(3)写出C与丙反应的离子方程式 ,列举这个反应的一种用途 。